新たなウイルスによるインフルエンザの流行がパンデミック直前の状態だと、世界中で大騒ぎになり、特に日本の水際防止という名の厳戒態勢ぶりは異様ともいえます。
今回のA型H1N1インフルエンザは、豚由来インフルエンザA/H1N1(Swine-origin influenza A/H1N1:S-OIV)とされていますが、全くの新型とすると矛盾する現象があり、未確定であることから、NPO法人医薬ビジランスセンター(薬のチェック)では、これを「2009A/H1N1」と呼ぶことにしています。
インフルエンザやふつうのかぜでさえ、非ステロイド抗炎症剤でライ症候群や脳症から多臓器不全を起こして死亡する例が少なくありません。また、タミフルによる突然死や異常行動、統合失調症を思わせる重大な精神障害がタミフルを予防に使用しても生じていますが、なぜか今回の流行に際して、非ステロイド抗炎症剤の害や、タミフルの害が全く議論になっていません。
2009A/H1N1の流行に関しては、近日中に別に論じたいと思います。今回はとりあえず、「新型インフルエンザの世界的流行、パンデミックは本当にくるのか?」というテーマで本年3月に書いた論文(「診断と治療」2009年3月号:pdf版)を紹介しておきたいと思います。
結論は、
「鳥インフルエンザウイルスから変異した新型インフルエンザウイルスでパンデミックが起きるとは思えない。万が一流行したとしても、今の日本で、メディアで騒がれているような1918年のスペインかぜの時ほど多数が死亡することはあり得ない」
です。
ただし前提があります。
です。
ウイルスの培養やワクチン製造に使われる鶏卵の中で、偶然出来上がった人為ミスの可能性が報道されています。
実際その可能性もあります。しかし、NPO法人医薬ビジランスセンター(薬のチェック)では、「診断と治療」2009年3月号ですでに論じたように、むしろさらに積極的に、高病原性遺伝子をヒト型インフルエンザウイルスに組み込み、ブタに接種する実験が米国中心になされていることを重視しています。このため、人為的に確実に高病原性を獲得させたヒト型インフルエンザウイルスが実験室から一般社会に出る可能性があると考えています。
以下、「診断と治療」2009年3月号を、出版社の許可を得て転載します。
新型インフルエンザの世界的流行、パンデミックは本当にくるのか?という大きなテーマを頂いた。結論は、鳥インフルエンザウイルスから変異した新型インフルエンザウイルスでパンデミックが起きるとは思えない。同様の批判はすでにある[1,2]。万が一、流行したとして、今の日本で、メディアで騒がれているような1918(大正7)年のスペインかぜの時ほど多数が死亡することはあり得ない。
WHOをはじめ、世界中の大部分の政府機関が新型インフルエンザのパンデミックが近々来ることを前提にして施策を考え準備している時期に、真っ向からの反対意見は「不届き千万」と思われる方は多だろう。しかし、かなり確実な根拠に基づいている。
しかし、高病原性の遺伝子を組み込まれたヒト型インフルエンザウイルスが実験室から持ち出され、市中に侵入し蔓延してパンデミックを起こすという危険性は否定できない。鳥型からの変異よりも、こちらの方がはるかにその確率は大きいのではないか。
高病原性のインフルエンザが流行したとして、リン酸オセルタミビル(タミフル)やザナミビル(リレンザ)などのノイラミニダーゼ阻害剤(NA阻害剤)を用いることが、その蔓延防止や治療に効果が期待できるのか、についても疑問である。その根拠についても述べたい。なお、本稿ではパンデミックの可能性のあるA型インフルエンザに限って論じる。
まず、インフルエンザの鳥型とヒト型の違い、パンデミックは鳥型のままでは起きないこと、重症化にかかわる炎症性サイトカインの重要性、それに対する非ステロイド抗炎症剤(NSAIDs)の関与、鳥インフルエンザのヒトへの感染率と死亡率など、現在判明している基本的事実に触れておきたい。
鳥インフルエンザのHAは16種類(H1〜H16)、NAは9種類(N1〜N9)が発見されている。最も強毒性のウイルスはH5N1型高病原性ウイルスである。ヒトのHAはH1〜H3、NAはN1とN2が確認されている。鳥のH5は特別な例外を除いてヒトには通常感染しない。このことは一般にはよく知られているが、同じH1どうしでも、鳥のウイルスはヒトには原則的には感染しないことは案外知られていないのではないか。
インフルエンウイルスのシアル酸(sialic acid:SA:ノイラミン酸)は鳥とヒトとでは、立体異性体の関係にあり、このため、細胞のガラクトース(レセプター)と結合する部位は鳥とヒトでは異なる[3-a]。鳥ではガラクトースの3位の炭素とシアル酸の2位の炭素が結合するα2,3結合であるが、ヒトではガラクトースの6位の炭素とシアル酸の2位の炭素が結合するα2,6結合である[3-a]。そしてヒトの気管支粘膜上皮細胞に含まれるのは大部分がSAα2,6ガラクトースであり、アヒルの腸粘膜上皮細胞に含まれているのは大部分がSAα2,3ガラクトースである[3-a](ただし、絶対ではないため例外はありうる[3-a])。このように、立体異性体であること、そのために、受容体への結合方法が異なるために、基本的に両者は異なり、一部の例外を除いて原則的に相互に感染しない。ただし、これは顕性感染を起こさないというだけで、不顕性感染はありうるようだ。その理由は後述がH5N1やH5N2に対する抗体を養鶏業従業員だけでなく、その周囲の人も相当保有しているからだ(文献も後述)。
現在、死亡率が高いとされているインフルエンザウイルスは、高病原性のH5N1鳥インフルエンザウイルスである。しかし、鳥インフルエンザウイルスでヒトからヒトへのパンデミックが起こりようのないことは、前項で述べたようにシアル酸の立体異性体の関係、レセプターの違いから明らかである。
パンデミックの可能性が怖れられているのは、これまでのパンデミックの変異の様子からの仮定として、鳥インフルエンザの高病原性遺伝子が組み込まれたヒト型ウイルスによるパンデミックである。しばしば「鳥インフルエンザのパンデミック」という表現が使われるが、したがって適切でない。
ヒポクラテスの時代から解熱剤が利用されるようになった19世紀半ばまでの約2000年間、感染したときに熱が出るのは体にとって有益な兆候とみられていた[4]。たとえば17世紀、英国の医師・シデナムは、「熱は、自然が与えてくれた外敵に勝つための原動力(エンジン)だ」と書いている[4]。発熱は、感染した細菌やウイルスの排除に重要な役割を持っている。
インフルエンザウイルスの失活に対して、発熱とともに重要なのは、炎症性サイトカインである。インフルエンザウイルスが、単球-マクロファージに感染すると、それぞれのサイトカイン誘導に必要なタンパクが合成され、TNF-α、インターロイキン(IL)-1β、IL-6、インターフェロンなどが誘導され[5]、発熱などの全身反応を生じる。この結果、症状が出始め、インターフェロンが出始めてから半日後には、鼻粘膜中のインフルエンザウイルスは減少し始める[3b]。
ライ症候群[6]やインフルエンザ脳症等重症脳症[7]、敗血症性ショック、高病原性鳥インフルエンザによる死亡者[8]で炎症性サイトカインが異常高値となっていることはよく知られている。インフルエンザ脳症の予防に対するオセルタミビルの有効性のエビデンス(証拠)はなく、むしろ「否定的」とされている[9]。その理由として、「インフルエンザ脳症は、インフルエンザウイルスの感染が引き金になってはいるが、病態形成の中心はウイルスによる細胞傷害ではなく、免疫システムの過剰反応、すなわち過剰な炎症性サイトカインの産生・放出にあること(cytokine storm)」「オセルタミビルは・・cytokine stormの発来は防止できないこと」とされている[9]。
1918/19年パンデミックでも多くの人は数日間の激しい症状の後に回復したが、重症化例では、病変は全身におよび、DIC様の全身の出血、意識障害・精神症状(脳症症状)、急性呼吸窮迫症候群(ARDS)の徴候を備え、硬化病変を主体とする通常の肺炎とは極めて異なる場合が多かったとされている。すなわち、これらは、今日サイトカインストームによって生じる病変に一致していると考えられている[10]。特に若者の死亡者が多かった軍隊における解剖例のほぼ半数に今日ARDSと呼ぶべき所見が認められたという。軍隊では特にアスピリンの使用が多かった。
非ステロイド抗炎症剤系解熱剤(NSAIDs解熱剤)を感染動物に使用すると死亡率を増加させることは10論文16実験のメタ解析の結果で示されている(統合Petoオッズ比:7.52:95%信頼区間(CI)4.58-12.35,p<0.00001)[11]。米国のライ症候群の8件の症例対照研究を併合した場合のアスピリン(サリチル酸製剤)使用の統合オッズ比は19.79(95%信頼区間10.46-30.43、p<0.00001)であった。すでにアスピリンはライ症候群の原因として確立している[11]。日本でも、擬似症例対照研究(脳症死亡例と脳症生存例の比較)3件と1件の症例対照研究(脳症死亡例と非脳症対照との比較)を併合したNSAIDs使用の統合オッズ比は15.20(95%CI:3.52-65.55、p=0.0003)であった[11]。脳症死亡例と非脳症対照との比較では、オッズ比47.4(95% CI:3.29-1458、p=0.0019)であった[11]。
NSAIDsは動物でもヒトでも、感染時に使用すると致死的疾患を増加させ死亡率を増加させると結論できる[11]。
感染動物にNSAIDsを使用した実験から、ウイルスも細菌も、NSAIDsを使用すると、血中や臓器中に、平均数倍から20倍(細菌)、あるいは100倍(ウイルス)増加し、インターフェロンなどサイトカインは増加した[12,13]。
また、in vitroでもNSAIDsがTNF-αの誘導を増強することが確認されている[8]。アスピリンおよびインドメタシンが、エンドトキシンで刺激されたマクロファージからのTNF-αの誘導を増強した。しかもインドメタシンはアスピリンの10分の1の濃度でもアスピリンよりも強く増強したが、アセトアミノフェンでは誘導増強がほとんどなかった[6]。
1889年から1890年にかけてもパンデミックが記録され、さらには、1900年から1903年にかけても中等度の流行があったと記録されている。1889年流行ウイルスはH2N8(ウマ型)、1900年流行はH3N8(ウマ型)であったとされている[14]が、それらがヒトからヒトに感染してパンデミックを起こしたヒトインフルエンザウイルスであるとのコンセンサスは得られていない[3-b]。したがって、単にウマインフルエンザが多くのヒトに対して感染しただけであったのかもしれない。
NSAIDsは、サリシン(1827年)、サリチル酸(1838年)、サリチル酸ナトリウム(1875年)の限定的な使用の後、1884年のアンチピリンやすぐその後のアミノピリンの登場で本格的に医療に用いられるようになった[15]。アセトアミノフェンは1893年に導入されたがあまり普及しなかった。しかし、アスピリンは1899年に医療用として市販、1915年から一般用薬剤(OTC薬剤)として市販され急速に広く使用されるようになった[15] 。
スペインかぜの流行に際しては、インフルエンザ治療にアスピリンの使用が推奨された。1日100グレイン(約6.5g)あるいは、48時間で240グレイン(約15.6g)を使用した例も記録されている[16]。いわば乱用とも言うべき使用がなされたようである。そして、アスピリンを使うほど「治りが遅い」あるいは「死亡が多い」との印象が異口同音に語られている[16]。この中で、アスピリン使用と不使用が比較できる調査が少数ながらあった。たとえば、一般市民の治療で、アスピリン不使用では575人中死亡は1人(0.17%)であったが、アスピリンが用いられた大学病院では294人中15人(5.1%)が死亡したとの報告があった。これだと、オッズ比30.9(95%CI:4.3-630、p=0.0000003)である。また他にも、アスピリンなしでは1.05%、アスピリン使用で30%の死亡、軍隊では、アスピリンなしでは死亡は3%未満、アスピリン使用で20%が死亡したとの報告がある。動物実験や症例対照研究でのNSAIDsの死亡危険のオッズ比とほぼ同等の死亡危険度であり、アスピリン使用の寄与危険度はほぼ90%を超えると考えられる。
アスピリンがインフルエンザにおける死亡を増加させた可能性については、動物実験や、その後ライ症候群との因果関係が確立されたことなどからみて当然ありうると考える。単にありうるというレベルではなく、むしろ積極的に主要な原因であったのではないかと考えている。
ついで、ヒトが鳥インフルエンザに感染しても「重症化や死亡はまれ」という点が重要と考える。
WHOでは、高病原性インフルエンザ罹患者の症例死亡率(発症者中の死亡者の割合:case fatality)を2008年11月10日現在、63%(245/387)としている。特にインドネシアでは82%(112/137)と極めて高い。WHOの症例死亡率を見る限りは、死亡率は高いという印象を多くの人が持つのも無理はない。しかし実際のところは、不顕性感染が多く、ヒトどうしの感染もありうるが、重症化や死亡は極めてまれである。
症例死亡率とは、たとえば、ライ症候群など脳症を発症した患者のうちの死亡した患者の割合をいう。2000年以前は、脳症の症例死亡率はおおむね約30%であった。このうち、NSAIDs使用者の症例死亡率は52%から67%であった。しかし、これをもってインフルエンザやかぜにNSAIDsを使用して60%前後が死亡するとはだれも思わない。日常の診療から明らかだからである。
同様に、鳥インフルエンザの症例死亡率が平均60%と高いのは、WHOに登録される鳥インフルエンザに罹患した重症発症者、いわば最初から脳症のような重症例が分母になっているからである。高病原性インフルエンザといえども、それが全ての人に高病原性とはいえない。感染者全体を母数にするとどうなるのであろうか。この点について、疑問を呈した論文も見られるが、全体像は未だに不明である。
そこで、実際の感染者、軽症発病者も含めた発病者の割合がどの程度か、できる限り資料を集めて検討してみよう。最も正確な調査は香港での調査である。
香港で鳥インフルエンザが人に感染して死亡者が出た1997年、香港の養鶏業従業員ら約1525人が調査され、81人がマイクロ中和法とWestern blot法でH5抗体陽性であった。30-44歳では12.3%(56/806)、年齢調整の結果では全体の10%が抗体陽性であった[17]。つまりこれらのヒトにはH5の感染があったということを示している。また、家禽が10%超の死亡率を示した養鶏業従業員であることや、家禽の解体従事者が最も抗体陽性の危険度が高く、また従事する作業の種類が多いほど、抗体陽性率が高くなっていた[17]。
鳥からヒトへの新たな感染は、政府機関の職員293人(年齢中間値41歳)の調査[17]で判明する。また、ヒトからヒトへの濃厚接触は、重症患者の医療に直接関与した医療従事者や、重症患者の家族で判明する(文献割愛)。
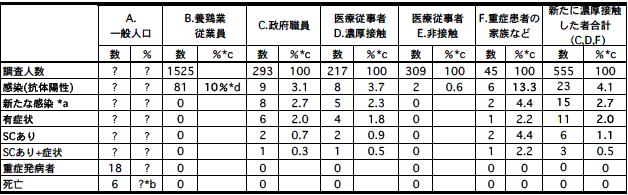
これらについて調査された結果を表1にまとめた。政府機関の職員と重症患者の医療に携わった医療従事者とで、抗体保有割合、新たな感染、有症状、セロコンバージョンの割合はほぼ同じである。また、重症患者の家族でも抗体保有割合を除けば、ほぼ同じである。重症患者の家族で抗体保有者6人中5人は家禽を扱っていた。抗体保有割合が高いのはこのためであり、症状の出なかった4人は既感染者であったと考えられる。
したがって、表1から、
香港での18人の重症鳥インフルエンザ患者中の症例死亡率は6人(33%)であったが、122人(104+18)中の6人とすると、たかだか5%である。調べられていない不顕性感染者は104人よりはるかに多いと考えられるので、実際の死亡率はこれよりはるかに少なくなるであろう(なお、ベトナムなどでは、抗体陽性者が出ていないが、原因は不明)。
日本で初めて鳥インフルエンザが流行したときも、京都府内の養鶏業者の従業員16人中4人(25%)は、鳥インフルエンザの抗体が陽性であった[18]。鳥インフルエンザが流行した養鶏業者の鳥の処理に従事した京都府職員42人中1人が鳥インフルエンザ抗体(H5抗体)陽性で、軽い症状(のどの痛み)が出たことも確認されている。特に従業員の1人は、抗体が陰性から陽性にセロコンバージョンした[18]。つまりこの人は、鳥インフルエンザに感染し、軽症だが発病した。この人はタミフルを服用していなかった。また京都府職員の多くはタミフルを前もって服用して、作業に従事した。抗体が陰性のままで「発熱や悪寒等を訴える者があった」が、迅速検査では陰性であったという[18]。タミフルはインフルエンザウイルスの抗体産生を妨げないとのデータはあるが、抗体産生を抑制するとの知見もある。京都府職員での症状出現と抗体陰性の結果をみると、抗体産生を抑制するのかも知れない。
タミフルは、検査陽性のインフルエンザ感染は防止するが、インフルエンザ症状の出現は予防しない[19]。同様に、鳥インフルエンザの感染予防にタミフルを使っても、インフルエンザは通常のインフルエンザ同様、迅速検査で「インフルエンザ」と診断できなくなるだけで、インフルエンザ症状の発症を抑えることはできず、軽い発病あるいは、不顕性感染は生じるということである。
H5N1以外では、H5N2(日本では茨城県で流行)、H7N3、H7N7、H9N2などのヒトへの感染が報告されている。2003年にオランダで発生したH9N2高病原性鳥インフルエンザには89人が感染し、83人に結膜炎症状が出現した。大部分は軽微な症状が現れただけであったが、1人の獣医が肺炎とARDSを伴い死亡した(受診前の治療内容は不明である)。ヒトからヒトへの感染(発病)が3件で認められ、感染(発病)した養鶏業従業員と接触のあった59%が抗体陽性となった[3b]。
以上、香港や日本での鳥インフルエンザの流行時のヒトへの感染状態をみると、ヒトが鳥インフルエンザウイルスに曝された場合には、鳥インフルエンザに感染し、軽く発病する人も出る。ごくまれに出る重症者に濃厚に接した者の中にはヒトからヒトへの感染もありうるが、その場合でも軽症で済んでいる。なお、ベトナムで、娘を遠いところから訪ね、濃厚に看病した母親が感染発病し、肺炎で死亡した例が報告されているが、極めてまれである。
H5N1型鳥インフルエンザの高病原性の発現には、HAおよびNAの遺伝子、ウイルス増殖に関係するPB2遺伝子、ウイルスのシアル酸(SA)と宿主側受容体(galactose)の結合関係(SAα-2,3Gal結合が可能か否か)、サイトカインの攻撃と関係するNS1遺伝子、さらには、腫瘍壊死因子関連アポトーシス誘導リガンド(tumor necrosis factor-related apoptosis-inducing ligand:TRAIL)のupregulationや、CD8+ リンパ球の細胞傷害性の減少などが高病原性発現に関連しているのではないかと見られている[3-b.8,20] 。
これらの中でも、サイトカインの異常に関係するNS1遺伝子は精力的に検討され、ウイルスの増殖による組織傷害とともに高病原性発現の主要な機序の一つと考えられている[8]。
香港で流行したH5N1型鳥インフルエンザウイルスは、ヒトに感染する通常のインフルエンザウイルスや、他の型の鳥インフルエンザウイルス、ブタインフルエンザウイルスと異なり、インターフェロン(αとγ)やTNF-αの抗ウイルス作用に対して耐性を有していることが確認された[21]。これは、培養したブタ肺上皮細胞を用いたin vitroの実験で確認されたものである。この耐性の状態は、極めて顕著であり、インターフェロン(αとγ)やTNF-αいずれかに曝しておくと、通常のインフルエンザウイルスはまったく検出されなくなるが、H5N1型鳥インフルエンザウイルスは、インターフェロンやTNF-αなどに曝されていないウイルスと同程度のウイルス量を示したのである。つまり、インターフェロンやTNF-αによって増殖が全く抑制されなかったということを示している。
in vitroの実験だけでなくin vivo実験も行われている[21]。H5N1高病原性鳥インフルエンザウイルスのNS1遺伝子をH1N1ヒト型インフルエンザウイルスに組み込んでブタに感染させ、通常(wild type)のH1N1ヒト型インフルエンザウイルスを感染させたブタと比較している。ヒト型ウイルスを感染させた方が、ウイルス血症が著しく長期間続き、発熱も長時間で体重減少も著しかった[21]。
つまり、高病原性NS1遺伝子は、インターフェロンやTNF-αなどのサイトカインの攻撃を免れる性質を有していたこと、このNS1をヒト型H1N1に組み込んだインフルエンザウイルスは、H5N1と同様にサイトカインの攻撃を免れる性質を有するように変化するのである。
この事実は、HAが鳥型インフルエンザウイルスH5にならなくとも、またウイルス増殖に関係するPB1遺伝子や、ウイルスのシアル酸(SA)と宿主側受容体(galactose)がSAα-2,3Gal結合をする構造を持っていなくとも、ヒトの通常のインフルエンザウイルスH1N1に組み込まれれば、高病原性を発揮することにつながる。
そして、それが自然に起きることは、かなりまれなことであったとしても、実験室ではすでに遺伝子組み換えの方法を用いてブタに対して高病原性を発揮するH1N1が作られ、現実にブタが重症化しているのである。
したがって、自然に高病原性のウイルスができるというより、実験室から何らかの事故によって外界に飛び出す可能性のほうが、実際上よほど高いというべきであろう。
実際、SARSを研究していた研究者が感染して、外界に持ち出されそうになったことがあるが、高病原性インフルエンザウイルスに関しても、そうならないという保証はない。
この問題は、高病原性新型ウイルスが流行したとしてもスペインかぜの時のような規模にはなり得ないことに通じる。たとえばインフルエンザウイルスは基本的にはウイルス血症を起こさないといわれるが、動物の好中球をX線照射しておくとウイルス血症を起こす。NSAIDsを用いれば、通常は高病原性を持たない病原体でも高い死亡率を示すようになる。スペインかぜの時代は、人生わずか50年にもなっていなかった。戦争で人々は疲弊していた。現在の日本では寿命が男性約30年、女性では約35年以上延長した。ベトナムの平均寿命もすでに73.7歳(2005年、男女計)に達している。
あらゆる防御機構が完全であれば、一つの防御機構に欠陥があってもかろうじて重症化を免れているのかもしれない。しかし、こうした場合には、他のいずれかのわずかな異常が防御機能全体の破綻につながり重症化につながるであろう。
ヒトインフルエンザウイルスのHAは、スペインかぜ(H1N1)以降、ヒトで流行した順にH1からH3、NAもN1とN2と名付けられたものである。1957年のアジアかぜ(H2N2)、1968年の香港かぜ(H3N2)、1977年のソ連型(H1N1)とだんだんと軽くなり、パンデミックとも呼べない程度の規模になっている。そして、ソ連型のH1N1はスペインかぜと同じ型であるが、今ではH3N2より症状が軽いのが特徴でさえある。
日本では現在、香港かぜ(H3N2)のなごりが最も多く約半分を占め、ソ連型(H1N1)のなごりとB型がそれぞれ4分の1ずつ、入り混じって流行している(最近20年間の日本でのデータ)。アジアかぜ(H2N2)は1968年の香港かぜの流行以降、姿を消した。
鳥インフルエンザは、Hは16種類(H1〜H16)、Nは9種類(N1〜N9)が発見されている。理論的には144種類(16×9通り)の組み合わせがありうることになる。
鳥は1億年以上の歴史がある。Hが16種類ですべてであるとすると、Hの変異は約600万年に1回、Nの変異は1000万年以上に1回ということになる。
一方、ヒトの起源は、原人を含めると約180万年、ホモ・サピエンスの起源はたかだか数十万年前(20〜30万年)である。この間にHは3種類、Nは2種類を獲得した。人の起源を原人の歴史にとればHは60万年1種類、ホモ・サピエンスの起源を20万年前とすれば、7万年に1回の割合で大変異が生じたということになる。
鳥インフルエンザの遺伝子がヒト型に変化したとして、1回の変異に数万年を要していることになる。HやNの1〜3の型の変異は、これほどの長い期間をかけなければ起きない変異のはずである。
それが、ここ数年の間に急に起きるかもしれないといわれ始めたのは、いかにも不自然ではないか。 1918年のパンデミックを起こしたインフルエンザウイルスが鳥からの遺伝子が組み込まれたために新しくなりパンデミックを起こした、という説がほとんど疑いのない説として信じられている。この説は、系統発生の分析が根拠になっているが、その解釈はあいまいなものであり、解釈そのものに対する反対意見も少なくない[22,23]。したがって、鳥インフルエンザウイルスの遺伝子が組み込まれたということ自体、根拠は明確ではない。
一方、先述したように、高病原性の最大の因子ともいうべきサイトカインの攻撃を免れるNS1遺伝子の変異型を有するヒト型インフルエンザウイルスが実験室から外界に飛び出す可能性は、よほど現実的である。
京都府の職員がタミフルを服用して防疫作業に当たったけれども、抗体産生のないまま、発熱などの症状は出現した。タミフルの予防使用のRCTでは、発熱など症状は抑えていない[18]。べトナムやタイでの鳥インフルエンザ感染者にタミフルを2倍量使用しても効果がなかった。
また、H5N1が高病原性を発揮する最も重要な因子がNS1であるなら、その部位(およびその結果としての機能)にタミフルは全く無関係であるから、タミフルは理論的にも高病原性インフルエンザウイルスには無効である。
ベトナムなどでの鳥インフルエンザで重症になった症例の報告では、タミフルは全く効いていない。耐性ウイルスも、30%から50%出現する可能性があることが分かった。
たとえば、タイでは、タミフルを服用した10人中7人が死亡(死亡率70%)、服用しなかった7人中5人が死亡した(死亡率71%)。また、ベトナムのひとつの調査ではタミフルを服用した5人中4人死亡(死亡率80%)、服用しなかった人も5人中4人死亡(死亡率80%)した。ベトナムのホーチミン市では重症患者10人全員がタミフルを服用したが、80%が死亡した。さらに、最近の耐性ウイルスの報告では、タミフルを服用した8人中4人が死亡し、そのうち耐性ウイルスの検査がきちんとできた2人から耐性ウイルスが検出された。
タミフルが重症化や脳症を予防しないことは横田俊平氏も指摘している[9]。すなわち、インフルエンザの脳症や重症化は、サイトカインストームによるものであり、理論的にも実際的にもタミフルは無効である。なお、タミフルの害については筆者の著作[24-26]ならびにNPO法人医薬ビジランスセンター(薬のチェック)のホームページ(http://npojip.org)を参照頂きたい。
パンデミックは起きない、と言ったが、ただし書きがある。それは、イブプロフェンやロキソプロフェン、スルピリンなどを含め全てのNSAIDsを解熱剤として用いないことが条件である。小児だけでなく成人にも使用してはならない。また、ステロイドもパルス療法を含めて使用しないことである。これらNSAIDsやステロド剤を解熱目的で使用すると、一時的には症状は軽快したとしても、その後に高サイトカイン血症を起こしてかえって重症化する危険性が高い。
抗ヒスタミン剤なども無効であり、ケイレンの頻度を高めるので、用いるべきではない。余分な薬剤を用いず、保温と安静を保ち、患者の免疫力が最大限に発揮されるよう配慮することが肝要である。そうすれば重篤化や死亡増大の危険性はない。したがって、一部に見られるように、医療従事者自身が恐怖におびえるという必要はまったくない。
| 誤 | 正 | |
|---|---|---|
| p507 右列下から10行目 | PB1 | PB2 |