社団法人日本産婦人科医会が、開業医らに対して5月19日、妊婦や授乳中の女性がインフルエンザに感染した場合、抗インフルエンザウイルス剤(タミフル、リレンザ)の使用を勧める内容の通知を出したとの報道があり、早速、その問題点を指摘した意見書を19日付けで提出しました(速報No119)。
これに対して、5月20付けで「通知を変えることは致しません」との返事がメールでありました。
そこで、21日付けで再考を求める意見書を提出いたしましたが、提出後に、日本産婦人科医会のホームページ上に上記通知の内容が判明し、米国CDCの最新の情報[1]が「参考資料」としてあげられ、その重要な根拠となっていることが判明しました。そこで、この根拠についても考慮した内容を追加して、再考を求める意見書(改訂版)を作成し22日に改めて送付しました。日本産婦人科医会の返事と、再考を求める意見書(改訂版)を掲載します。
再考を求める意見書およびその改訂版作成の過程で、さらに詳細に検討した結果、新たに、流産や、胎児死亡の危険増大の害もありうることが判明しました。妊婦にタミフルを使用すると、流産や胎児死亡・新生児死亡、妊婦自身への害もありうるので、使用しないようにお願いいたします。
乳幼児や10代はもちろん、他の年齢についても不要・危険であることは、これまで同様です。
前略失礼いたします。ご意見と、添付論文を拝読いたしました。結論からいえば、日本産婦人科医会のタミフル、リレンザの通知を変えることは致しません。理由は以下の通りです。
従って、「治療上の有益性が危険性を上回ると判断される場合には、抗インフルエンザウイルス薬の使用をためらうべきではありません」とした次第です。
早速のご返事をありがとうございました。世界中が、ワクチンやタミフルの使用を無効にもかかわらず容認している中、また米国CDCもタミフルの妊婦への使用を容認するような文書を出している中、日本産婦人科医会のみが、逆の立場をとられることは、困難であるかも知れません。
しかしながら、貴会の判断は、以下の理由により、適切とは申せません。再度、ご考慮いただきますようお願い申し上げます。
「ラットの動物実験をそのまま人へ当てはめることはできません」とのご指摘は、一般的にはその通りです。しかしながら、ヒトでの適切な対照試験がなく、ヒト常用量に近い用量で動物に毒性が出ている場合には、動物実験データを重視する必要があります。
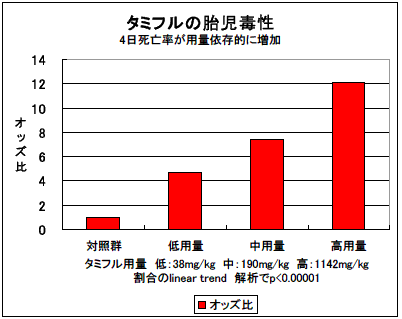
タミフルの妊婦・胎児への影響に関しては、ヒトでの適切な対照試験がありません。しかも、安全量(最大無毒性量)が決定されておらず、ヒト常用量換算2倍量でオッズ比が4.7(95%信頼区間1.58-14.1)であり、明瞭な死亡増加が認められ、きわめて危険である可能性があり、重視すべきものと考えます(図にオッズ比を示しておきました)。

日本産婦人科医会と日本産婦人科学会の見解は、CDCの方針を踏襲しておられるとのことですから、繰り返しません。
なお、貴会が入手されたすべての学術論文について、お示しいただければ幸甚です。
貴会の5月19日付け通知の大きな根拠として、米国CDCの最新の情報[1]を「参考資料」としてあげ、以下(斜体)のように述べられています。
アメリカのCDC=疾病対策センターの報告によると、「アメリカ国内で新型インフルエンザウイルスに感染したか、感染の疑いがある妊娠中の女性は今月10 日の時点で20 人に上り、3 人が入院した。このうち、喘息などを患っていた33 歳の女性は、抗ウイルス薬による治療を受けないでいたところ、容態が悪化し、赤ちゃんを出産したが、およそ2 週間後に女性は死亡した」とあり、このことから、CDCは、妊娠中の女性は、通常のインフルエンザと同様に新型のイ ンフルエンザでも重症になるおそれがあり、喘息などの病気がある場合には、特にリスクが高いとしています。
しかしながら、この女性(症例A)は、これまでに乾癬と喘息があり、4月14日に発症し15日に産婦人科医に受診し、おそらく内科医をも受診して迅速検査でインフルエンザ陽性として治療を受けていますが、その治療の内容は不明です。咳や発熱を生じてから4日目の19日に救急病院を受診したときにはすでに呼吸窮迫があり、直ちに挿管、人工換気装置が装着され、緊急で帝王切開により出産しています。21日は呼吸窮迫症候群(ARDS)に進展しています。
CDCがあげた別の症例(症例B)[1]では解熱剤として、非ステロイド抗炎症剤(NSAIDs)が使用されていますので、この女性にも4月15日から19日の間にNSAIDsが使用されているかもしれません(少なくとも使用を否定できる証拠はいまのところありません)。
CDC以外の検査センターのrRT-PCR (real-time reverse transcription-polymerase chain reaction)では、25日にタイピング不能のインフルエンザAウイルスとの結果を得ましたが、CDCでは確認できず、タミフルが使用された28日以降に繰り返し検査をして、ようやくCDCでいわゆる「新型」のA/H1N1と診断されたということです。したがって、タミフル使用後にも検査でウイルスは消えていないということになります。
CDCは、別のCDCの総説論文[2]を引用して、タミフルは発熱症状発現48時間を超えて用いても有効である可能性に言及しています。しかしその根拠とした2つの調査[3,4]は、いずれも観察調査であり、ランダム化比較試験ではありません。文献の一つ[3]では、タミフル服用者は(71%が入院後48時間を超えて服用開始)、入院15日目の死亡率がタミフル非使用者より低かったが、入院日数や30日目の死亡率には差はなかったとされています。またこの論文では、NSAIDsによる影響(交絡)が何も検討されていません。もう一つの根拠としている文献[4]は、後ろ向きコホート調査ですが、48時間以内の服用者が48時間を超えて服用した人に比較して入院期間が2日短かったというものです。この調査でもPubMedのサマリーを見る限りでは、NSAIDsとの交絡は考察されていません。
上記患者さん(症例A)は、重症化してからタミフルが使用されました。タミフル使用にもかかわらず死亡していますから、無効であったといえます。
そもそも、この症例1例だけで、しかも重症化するまでにタミフルが使用されなかったということをもって、タミフルを最初から使用していたら死亡を免れていた、という証拠には何らなりません。
解熱剤として、非ステロイド抗炎症剤(NSAIDs)が使用されていなかったかどうかさえ、不明なのですから。
米国では、小児に対するアスピリンは禁止されていますが、大人に対する規制はなく、またイブプロフェンは、小児の解熱にも成人の解熱にも用いられます。
症例Bでは、具体的な薬剤名は不明ですが、注射剤のNSAIDsが用いられたとされています。成人に対しては、感染症の解熱にNSAIDsが用いられた可能性は否定できません。
症例Aで4月15日から19日までにNSAIDsが用いられたとすれば、重症化は、インフルエンザの影響そのものより、NSAIDsの影響の方がはるかに強いということになります。
Patient A. On April 15, a woman aged 33 years at 35 weeks' gestation with a 1-day history of myalgias, dry cough, and low-grade fever was examined by her obstetrician-gynecologist. She had been in relatively good health and had been taking no medications other than prenatal vitamins, although she had a history of psoriasis and mild asthma. The patient had not recently traveled to Mexico. Rapid influenza diagnostic testing performed in the physician's office was positive.
On April 19, she was examined in a local emergency department, with worsening shortness of breath, fever, and productive cough. She experienced severe respiratory distress, with an oxygen saturation of approximately 80% on room air and a respiratory rate of approximately 30 breaths per minute. A chest radiograph revealed bilateral nodular infiltrates. The patient required intubation and was placed on mechanical ventilation. On April 19, an emergency cesarean delivery was performed, resulting in a female infant with Apgar scores of 4 at 1 minute after birth and of 6 at 5 minutes after birth; the infant is healthy and has been discharged home. On April 21, the patient developed acute respiratory distress syndrome (ARDS). The patient began receiving oseltamivir on April 28. She also received broad-spectrum antibiotics and remained on mechanical ventilation. The patient died on May 4.
On April 25, a nasopharyngeal swab specimen collected from patient A indicated an unsubtypable influenza A strain by real-time reverse transcription--polymerase chain reaction (rRT-PCR) at the San Antonio Metro Health Laboratory. The specimen was forwarded to the Virus Surveillance and Diagnostic Branch Laboratory, Influenza Division, CDC, where testing was inconclusive for novel influenza A (H1N1) virus. On April 30, a repeat nasopharyngeal specimen was collected, which was positive by rRT-PCR for novel influenza A (H1N1) virus at CDC.
患者A.4月15日、妊娠35週の33歳の女性が前日から筋肉痛と乾性の咳、軽度の発熱の症状があるとの訴えで産婦人科医を受診した。この女性は、それまでは乾癬の既往歴と軽度の喘息があったが、比較的元気で妊娠中用のビタミン剤以外は薬剤をなにも服用していなかった。この女性は最近メキシコに旅行したことはなかった。内科医のクリニックで実施された迅速検査ではインフルエンザ陽性であった。
4月19日、彼女は呼吸困難、発熱、痰を伴う咳が悪化したために救急病院を受診した。重篤な呼吸窮迫があり、酸素飽和度は室内空気で約80%、呼吸数30回/分であった。胸部レントゲンでは両側に結節状の浸潤影が認められた。挿管が必要となり人工換気装置が装着された。19日に緊急帝王切開が実施され、女児を出産。出生1分後のapgarスコアは4であり、5分後は6であった。児は元気でありその後退院し、帰宅した。21日には、患者は呼吸窮迫症候群(ARDS)となった。患者には28日からオセルタミビルが開始された。また、広域スペクトルの抗生物質が用いられ、人工換気が継続された。5月4日に死亡した。
4月25日採取した鼻咽頭スワブのreal-time reverse transcription-polymerase chain reaction(rRT-PCR)(San Antonio Metro Health Laboratoryで実施)による検査結果は、タイピング不能のインフルエンザAウイルスを示していた。この検体は、CDCインフルエンザ部門のVirus Surveillance and Diagnostic Branch Laboratoryに送付され、精密検査の結果、新型インフルエンザA(H1N1)かどうかの結論がでなかった。4月30日に、繰り返し鼻咽頭スワブが採取され検査された結果、CDCのrRT-PCRで「新型」インフルエンザA(H1N1)が陽性であった。