2021年12月24日、重症例以外のCOVID-19(いわゆる新型コロナウイルス感染症)の治療用剤として、抗ウイルス剤のモルヌピラビル(商品名ラゲブリオ、MSD社)が「特例承認」されました[1]。主に軽症で、何らかのリスク因子を持つ入院前患者を対象にしたランダム化比較試験(RCT)の中間解析の結果、入院または死亡のリスクを半減したことが根拠とされています。
適切な情報入手が困難でしたが、2022年1月22日現在、添付文書[1]や審査報告書[2]、査読済み論文[3]も公表されていることが判明したので、それらを点検しました。
特例承認の根拠となった「入院または死亡のリスクを半減した」との結論は、試験データに「トリック」ともういうべき重大な欠陥があるため、信用できません。レムデシビル[4,5]やバリシチニブ[6]と同様です。
モルヌピラビルも、レムデシビルやファビピラビルなどと同様、ヒトの体内の細胞内で、ウイルスやヒト細胞の複製に必須の遺伝子情報の元になる物質の偽物として働きます。そのため不完全な(あるいは変異した)ウイルスRNA鎖を作り、正常なウイルスの合成を阻害するとされています[7-10](註)。
註:モルヌピラビルは、体内でN-ヒドロキシシチジン(NHC)に変換されて活性体(MTPまたは、NHC-TP)となります。これは、シトシンやウラシルというDNAやRNAなどの原料になる核酸塩基に似た物質です。これが偽物の原料となりウイルス(SARS-CoV-2)のRNAの複製の際に読み違いを生じ、遺伝子変異を起こすと同時に、正常な修復機転も阻害して変異を固定するとされています[9]。それと同時に動物やヒトの細胞分裂をも抑制します[9]。
英国政府に提出されたMSD社の文書(MSD文書)[11]では、ヒトに使う濃度の半分以下(0.4倍)をイヌに投与すると1週間で全血球系の抑制(骨髄抑制)が生じています。14日間の投与までは一応可逆的とされていますが、計画通りの28日間投与では22日までに不可逆的になっていました。無毒性量(NOAEL)は、ヒト用量のわずか0.13倍でした。日本の、添付文書ではすべて可逆的であったかのような記載になっていますが、事実を伝えていません。
遺伝子毒性も指摘され、胎児の発生への影響のない無毒性量はヒト用量より低いことが英国の情報に記載されています[11]。したがって毒性も大いに心配です。
第2相試験[2]では、モルヌピラビル800mg群74人、同400mg群77人、同200mg群74人、プラセボ群74人の4群で、開始から29日までの入院または死亡が比較されました。その結果、それぞれ3人、3人、1人、4人でした。そして、上記のうち、悪化リスク因子が1つでもあり、発症から5日に開始した例では、それぞれ31人中1人、38人中2人、38人中1人、34人中4人でした。
この結果から、800mgが有効ではないかと考えられて、この用量で第Ⅲ相試験が実施されました。
第2相の結果をもとに、症状発現から5日以内で、悪化リスク因子(表1)少なくとも1つあるCOVID-19患者を対象にプラセボ対照ランダム化比較試験(RCT)が実施されました。目標人数は1500人、最終的に1443人が解析の対象になりました。

しかし、ほぼ半数についての解析が可能になった時点で、中間解析が実施され、入院または死亡を半減させた、という結果が大々的に報道されました[12]。
添付文書[1]にも、この結果が大きく書かれています。
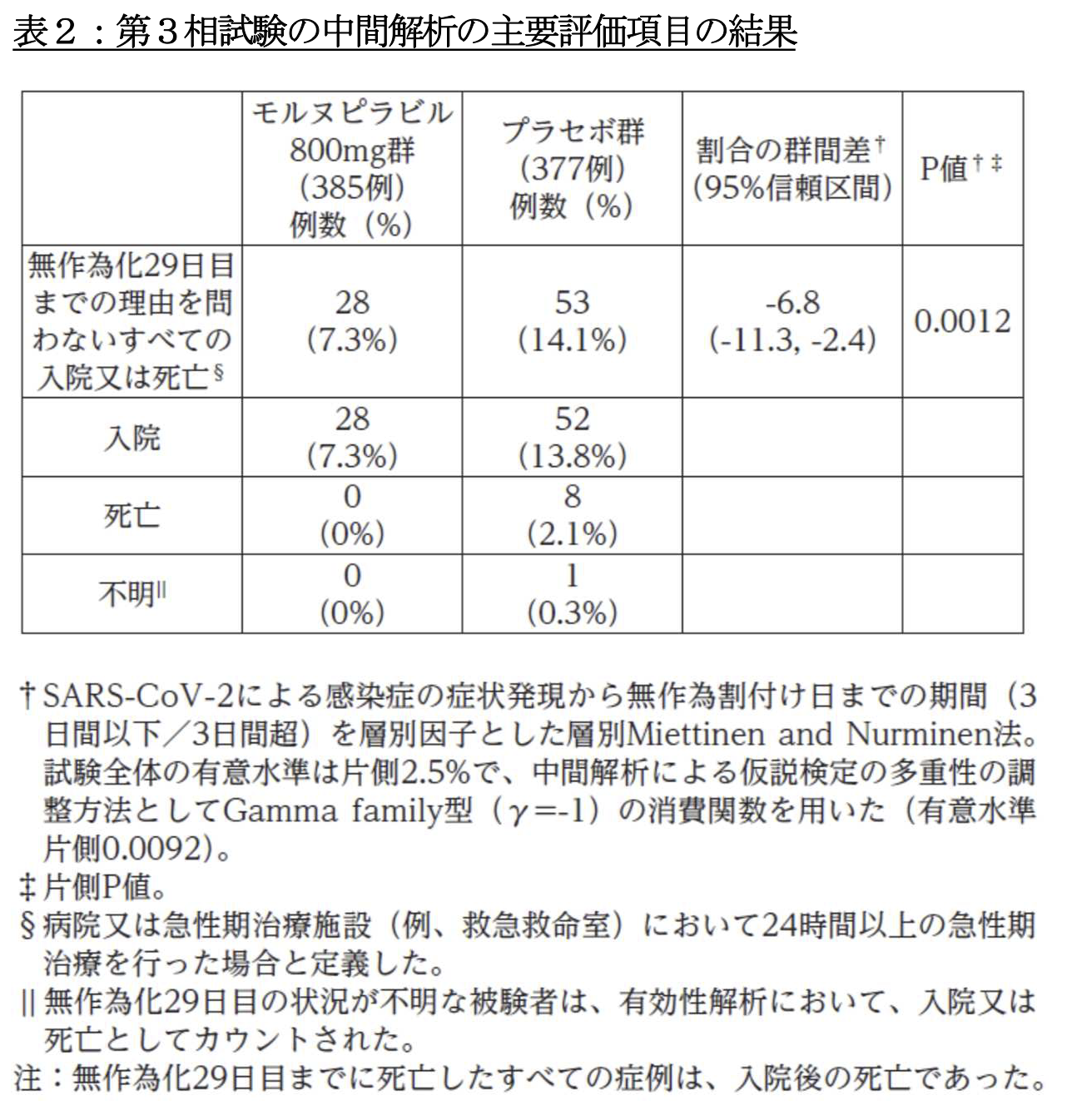
オッズ比は 0.48(95%信頼区間:0.30, 0.78, p=0.0024)ですから、このデータだけをみれば、割付から 29 日目までに入院または死亡を半減させた、といえそうです。 そのカラクリは後述します。
ところが、1433 人の全対象例を用いた解析で、入院または死亡はモルヌピラビル群は 709 人中 48 人(6.8%)、プラセボ群は 699 人中 68 人(9.7%)であり、
オッズ比は 0.67(95%信頼区間 0.46,0.99、p=0.044)とモルヌピラビル群に少なく、かろうじて有意でした。
中間解析には入れられず、その後最終解析で入れられた対象者でどうなったかを見てみましょう。29 日までに入院または死亡した例は、モルヌピラビル群は、324 人中 20 人(6.2%)、プラセボ群は 322 人中 15 人(4.7%)でした。オッズ比は、1.35(95% 信頼区間:0.68,2.68)でした。有意ではないものの(p=0.395)、モルヌピラビル群に 逆に入院や死亡が多くなっています。なぜこのようなことが起きたのでしょうか?
そのカギは、背景因子の大きな違いにあります。査読され公表された論文[3]は、2021 年 12 月 16 日に公表されたはずです。一般的に、このような論文の検索は、PubMed という最も一般的な文献検索ツールで、ランダム化比較試験制限をかけて“COVID- 19 molnupiravir”で検索するとヒットするはずです。ところが、この検索で検出され たのは3件だけ検出され、査読論文[3]は検出できませんでした。何も制限をかけない “COVID-19 molnupiravir”で検出した 88 件を丹念にみてようやく発見することが できました。今までに経験したことがなかった現象です。
この論文には、補充資料(Supplementary appendix)として、中間解析で用いた対象例についても、背景因子の割合が掲載されていました。この情報は、モルヌピラビルの審査報告書[2]や、添付文書[1]、MSD 文書[11]、米国の FDA の文書[13]などでは公表されていないデータです。
この背景因子の割合を、図1に示します。モルヌピラビル群に割合が多い背景因子のうち、女性(オッズ比 1.36、p=0.034)は有意に多く、肥満(オッズ比 1.33、p=0.94) は有意に近い差でした。逆に、慢性閉塞性呼吸器疾患(COPD() オッズ比0.31、p=0.0046) の割合はモルヌピラビルに有意に少なく、慢性腎障害(オッズ比 0.69)、糖尿病(0.82)、 活動性のがん(0.54)で少ない傾向がありました。これら4つの要因を合計した割合は、モルヌピラビル群が 19.4%、プラセボ群 28.4%で、オッズ比 0.61(p=0.0034)と有意でした。このようなことが偶然起こることは、200 回から 300 回に1回しか起こらないということを意味しています。きわめて深刻な偏りであり、意図的な操作が加えられない限り起こらないことです。
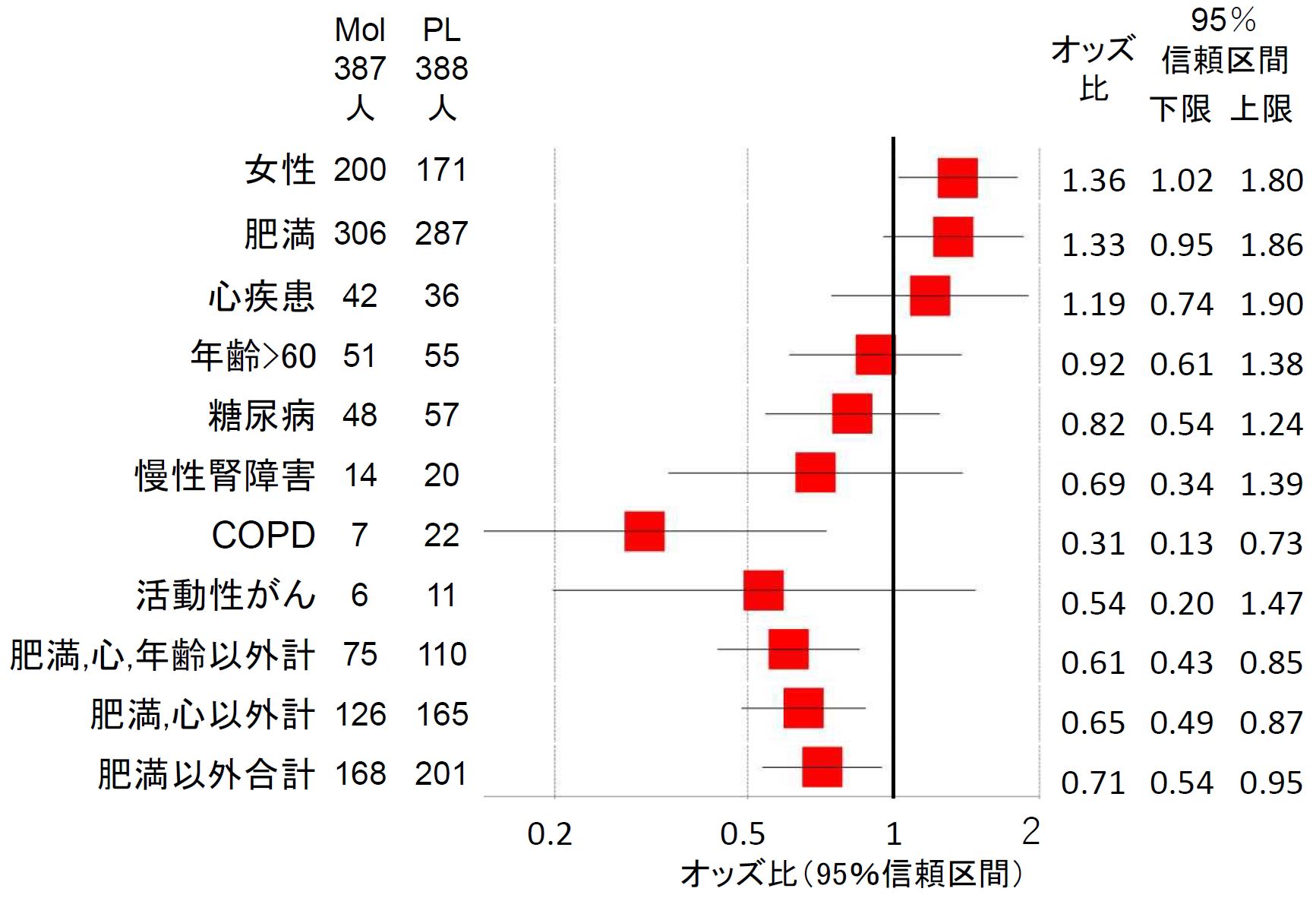
Mol:モルヌピラビル、PL:プラセボ、COPD:慢性閉塞性肺疾患 文献[3]データより著者作成
次に対象者全員の背景因子についてみてみましょう[3]。図2に示します。おおむね 同じ傾向がみられますが、全般的にその差は小さくなっています。しかし、肥満以外の COVID-19 悪化要因を合計した割合は、モルヌピラビル群に、やはり有意に少なか ったのです。モルヌピラビル群にこれら悪化要因が少なかったことが見かけのよい結果に影響したといえます。
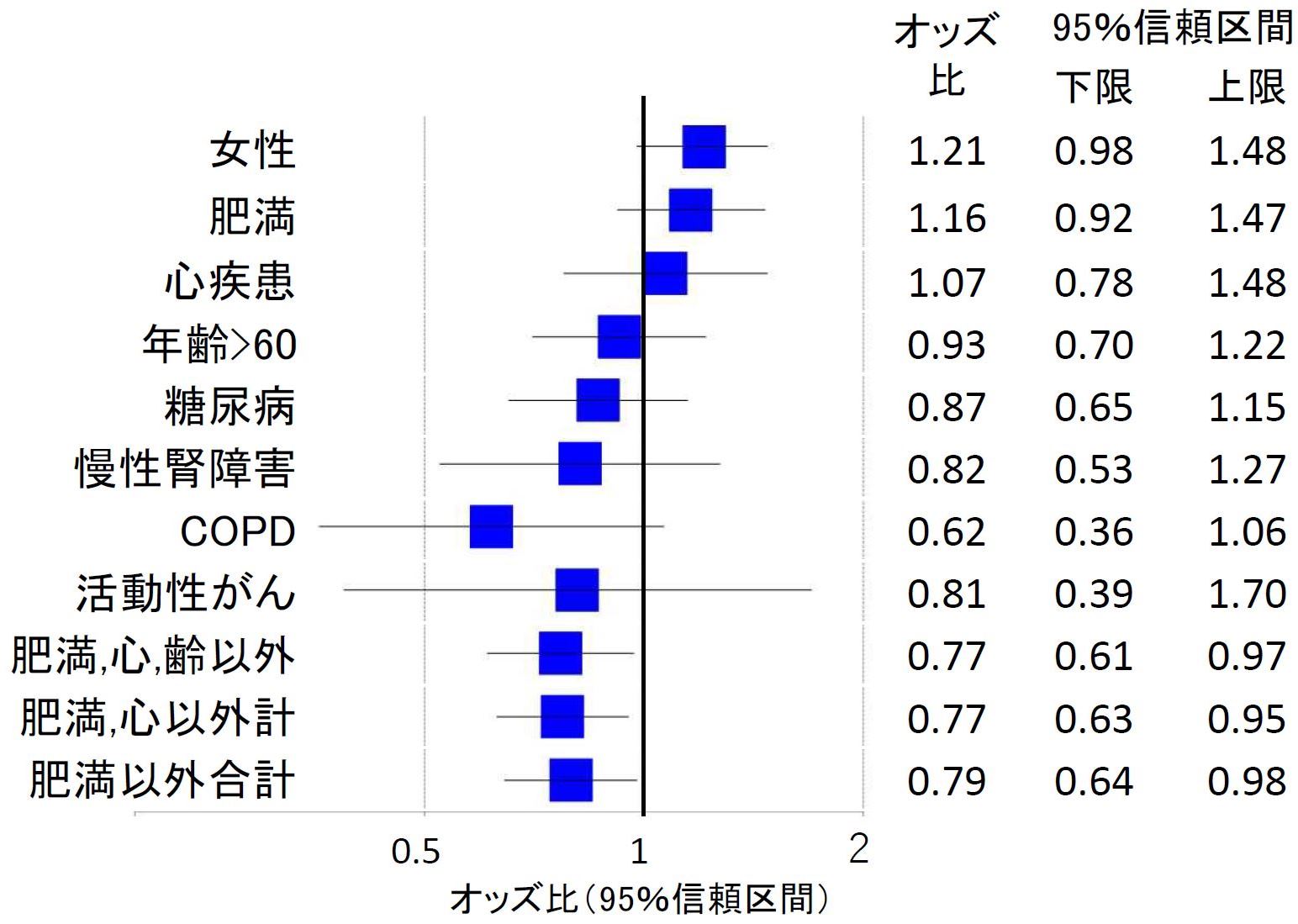
文献[3]データより著者作成
では、モルヌピラビルが有効であった人はいるのでしょうか。査読論文として公表された文献[3]のデータも不完全ですが検討してみましょう。
文献[3]の Figure 3 より抜粋
*a:SARS-CoV-2 のヌクレオカプシドに対する抗体が陽性であること。つまりワクチンでできる「スパイクたんぱくに対する抗体」ではなく SARS-CoV-2 ウイルス本体に対する抗体であり、既感染者を意味する。
*b:慢性腎障害、COPD、活動性のがんについてのサブグループ解析結果は、Supplementary appendix にも報告されていない。
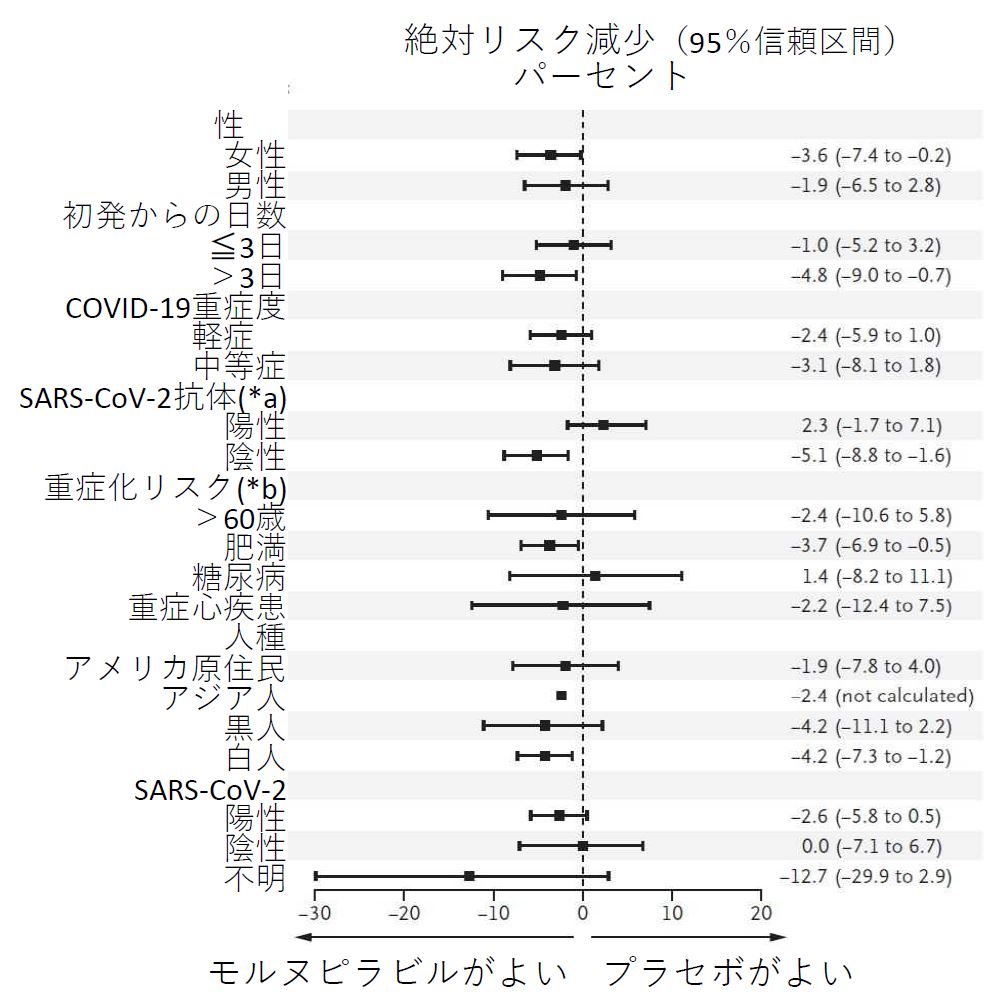
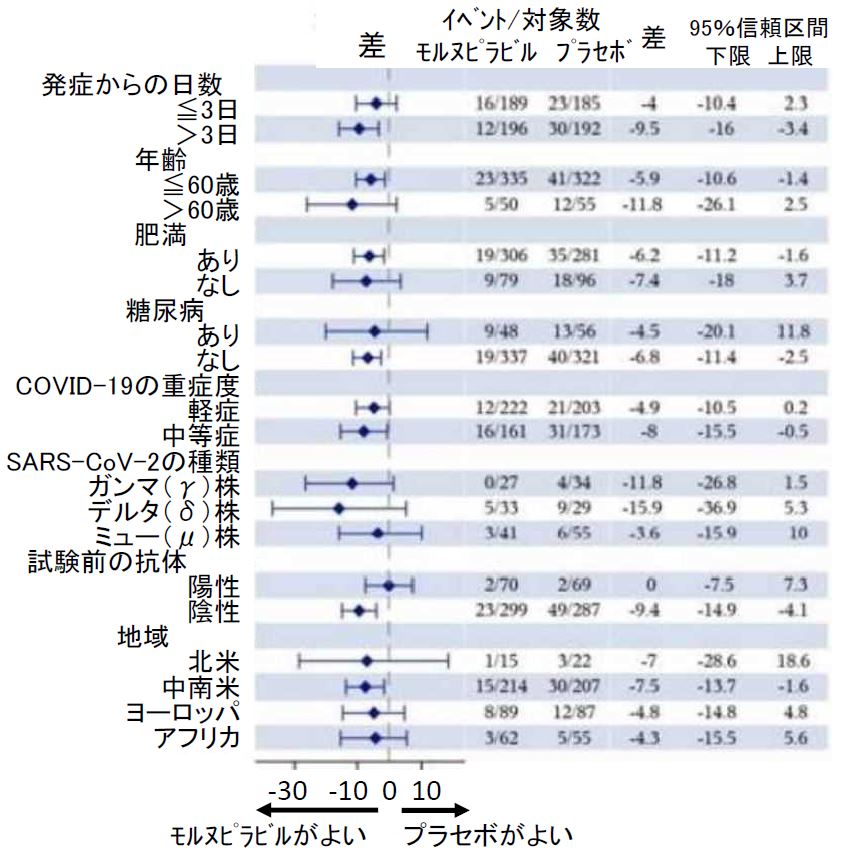
各種の要因別のモルヌピラビルの入院/死亡への効果(絶対リスク減少%)については、対象者全体については公表論文[3]に(図3)、中間解析については MSD 文書[11] に報告されていました(図4)。
図3の結果は、肥満の要因以外の重症化リスクのうち糖尿病や重症心臓病がある人に対して、モルヌピラビルは入院や死亡を減少させないことを示しています。慢性腎障害、COPD、活動性のがんのある人については、データは示されていませんでした。
図3の結果を単純に解釈すると、肥満者と女性で効果が認められている、と読めそうです。しかし、全体の半数を占める女性の中には当然、COPD や慢性腎障害、糖尿病、活動性のがんの人が含まれるので、モルヌピラビル群に少ないことがあり得ます。 また、重症化リスク因子の保有者を合計すると、モルヌピラビル群(923 人)は対象者の 1.29 倍、プラセボ群(944 人)は対象者の 1.32 倍に上ります。したがって、重症化リスクを複数有する人がいるわけで、対象者の4分の3を占める肥満者中、モルヌピラビル群に重症化リスクが有意に少ない可能性はやはりありうるでしょう。
しかし、女性中、あるいは肥満者中の、肥満以外の重症化リスク因子保有者の両群の違いに関するデータは示されていませんし、各要因別の入院/死亡の割合差のデータ (図3)は、重症化リスク因子の有無で調整されたものではありません。したがって、 肥満者と女性への効果についても疑問と言わざるを得ません。
これらを総合すると、背景因子でこれら重症化危険因子を持っている人がモルヌピラビル群に有意に少なかったことが、全体的にも、また因子別サブグループ解析で効いているように見える女性や肥満者においても、モルヌピラビル群に有利に働いたと考えられます。
文献[11]より引用
繰り返しますが、試験開始時に慢性腎障害や COPD、活動性のがんをもっていた対 象者についてのサブグループ解析結果は報告されていませんでした。また、中間解析 のサブグループ解析結果が、MSD 文書[11]にありましたが、対象者全体の要因別解析 結果よりも、強い傾向がみられた他、特別新たな情報は得られませんでした(重症度 別のサブグループ解析の問題点は後述)。
審査報告書によれば、日本からは 8 人(モルヌピラビル群 5 人、プラセボ群3人) が組み入れられ、7 人(5 人と2人)が試験製剤を1回以上服用したとのことです。こ のうち、モルヌピラビル群の1人が入院し、重篤な有害事象もモルヌピラビル群に1 人いた、と報告しています。中間解析に入れられた人はいませんでした[2]。
中間解析で特にモルヌピラビルの効果が顕著であった最大の理由は、背景因子の偏りがより大きかったためでしょう。
最終解析で、糖尿病や慢性腎障害、COPD、活動性のがんをもっていた対象者が有意に(p=0.026)モルヌピラビル群に少なかったことは、公平なランダム割り付けがな されなかった可能性を示唆します。さらに、中間解析における COPD の顕著な偏り(3 分の1以下で、p=0.0046)は、中間解析の対象者の選択において、遮蔽が外れていて恣意的な選択がなされた可能性を強く示唆します。
遮蔽が外れ、モルヌピラビル群でよい結果の人を優先的に中間解析に組み入れ、プラセボ群で入院した人を優先的に中間解析に組み入れたのではないかとの疑いも生じうるほど、不自然な結果でした。
臨床試験総括報告書が開示され、公に厳密な検討がなされなければならないでしょう(後述)。
なお、日本では、BMI が 30 以上の人は人口の 4.5%しかいません。したがって、仮に肥満者では本当に効果があったとしても、そのデータは、日本にはほとんど当てはまりません。
モルヌピラビルの臨床試験についてのシステマティックレビュー[8]があります。これによると、3件の第3相試験が、試験の途中で有効性を証明できる可能性がなくなったことが判明したために、試験を中止したとのことです。
中等症を対象にした2件、重症患者を対象にした試験が1件でしたが、いずれも公表論文はないとされています。
MSD文書[11]では、中間解析のサブグループ解析で、軽症例は有意の改善ではなかったけれども、中等症が有意に入院/死亡を減らした(絶対リスク差=-8.0%、95%信頼区間:-15.5,-0.5%)とされています(図4)。
しかしこの結果は、2件のRCTが効力を証明できる可能性がないと判断されて途中で中止となったことと、著しく矛盾するものです。この点からも公表されたモルヌピラビルの試験結果[3]は信頼できません。
COVID-19の治療用の抗ウイルス剤として現在、レムデシビル[4,5]やバリシチニブ[6]が特例承認されています。しかし、これらの薬剤もそうでしたが、今回検討したモルヌピラビルも、トリックともいうべき手法を用いなければ有効との結果を出せないものでした。
公表データでは効力も安全性も確証がなかったオセルタミビル(タミフル)などノイラミニダーゼ阻害剤については、試験総括報告書がヨーロッパの規制当局への請求で開示され、システマティックレビューが可能になりました[14]。その結果、インフルエンザウイルス減少効果はなく、症状改善効果はわずかで、精神神経系、腎、糖尿病誘発などの害があることが判明しました[14-16]。
COVID-19治療用の抗ウイルス剤についても、総括報告書が開示され、それを検証する必要があります。それが示され、再解析がなされるまで使用を中止すべきと考えます。
特例承認されたモルヌピラビルの根拠となった臨床試験では、COPDをはじめ、糖尿病、慢性腎障害、活動性のがんなど重症化リスクを持つ人がモルヌピラビル群に少なく、その差は有意でした。中間解析でその傾向がさらに大きくなったために、中間解析で特に顕著なよい結果が出たと考えられました。BMI 30以上の人や女性に有効に見えるサブグループ解析の結果も適切な解析がなされていないために、信頼できません。
抗ウイルス剤の臨床試験には矛盾が多すぎます。モルヌピラビルを含め、開示情報で再解析して本当に効果があり、安全なのか再検討が必要です。それまで使用すべきではありません。