以下のような趣旨の発言がなされた。
- 東京女子医大でブレオマイシン肺線維症研究を担当した青芝医師:
- ブレオマイシンの肺線維症は人の間質性肺炎とは病増が違うので、人には当てはまらない。
- それならなぜ実施したか(動物に現れた毒性は大部分人でも現れる)
- 人臨床試験(INTACT)と同様の実験であり人で再現されている
- 肺線維症合併肺癌患者への使用を慎重にすべきと、ブレオマイシン肺線維症に特定せず「肺線維症一般」への注意に普遍化して結論している。
- したがって、この実験結果が承認前に厚労省に報告されていたとしても、承認には影響はなかったと思う
- INTACT試験の結果と合わせて重視すべきデータである
- それならなぜアストラゼネカ社は提出しなかったのか
- ブレオマイシンの肺線維症は人の間質性肺炎とは病増が違うので、人には当てはまらない。
- 別の委員:
- なお、「研究者による同結果の発表妨害」に関して、アストラゼネカ社が重視していた「研究者の手続き不備」については、何も指摘はなかった。
厚労省からは、「医師からの最初の報告がグレード3であり、その後訂正は口頭報告であって訂正が不十分であったために、グレード3のままになった。これが4であったとしても、承認には変更はなかった。」との趣旨が説明された。
→しかし、「CTCグレードは、副作用を含む有害事象の重症度をあらわすもので、---副作用報告に用いられる重篤度とは異なる尺度です。」という、3月31日のアストラゼネカ社の回答での理由と全く異なる説明であり、当事者の医師の確認はとれていない。
- 開示を要望した動物の毒性情報:
- 反復毒性試験(ラット、イヌ、それぞれの、予備試験、1ヵ月、6ヵ月試験)の実施日、実施施設名もふくめ、報告書原本のすべて
- この意見に対する唯一の意見は「肺毒性に関しては、所見がなかった。所見があれば記載している」というものであった。
→これは、アストラゼネカ社の回答とも異なる。
- アストラゼネカ社の主要理由は「営業秘密で開示できない」である
- アストラゼネカ社は「呼吸器系の異常所見は認められなかった」でなく,
- 本薬に起因する異常所見は認められなかった」と,呼吸器系に何らかの異常所見を認めた可能性を含んだ表現をしている。
- しかも、用量依存的白血球の増多や相対肺重量増も認めている(したがって、肺に所見が無いはずがない)。
- だからこそ、毒性実験データの全面的な開示を求めているのである。
NPOJIPでは、以下の開示を要望していた
- 有害事象による死亡例および、有害事象によるイレッサ中止例の個別の経過、
- 日本の臨床試験のすべての死亡例、有害事象によるイレッサ中止例の個別の経過、
- とくに第Ⅰ相臨床試験における2人の「死亡に至る有害事象例」(呼吸窮迫症候群と肺炎)の詳細な経過、
- No39臨床試験における、p507表トー113の欄外に記載された、集計に含まれていないとされる500mg群の4例の死亡例の詳細な経過、
- 日本の臨床試験の全死亡例および表ト28(p426)中、重篤であると疑われるメレナ(5人)、血尿(5人)、呼吸困難(1人)、低酸素症(1人)の症例の詳細な経過報告
→検討会ではこれらの件に関して、新たな情報の開示は一切無かった。
- たとえば、呼吸窮迫症候群の50歳代の女性はイレッサを使用し呼吸窮迫症候群を生じたためイレッサを中止したが死亡した。関連が疑われたからこそ中止したこれら多数の例を、なぜ開示しないのか。
- 日本の臨床試験中メレナ(5人)や低酸素症(1人)など病名からして重篤とおもわれるが、いずれも重篤な例のなかに分類されていない。
これら以外にも多数の濃厚な関連が疑われる例の中から絞って情報開示を求めた。
これら情報の適切な再評価をして初めて、承認審査過程の検証が可能である。その情報の開示なしに、審査過程の検証は不可能である(詳細はイレッサ情報No12)。
- 開示を要望した情報:
- 第Ⅲ相臨床試験(INTACT-1、INTACT-2)における、有害事象や副作用、それぞれによる死亡の頻度を、プラシーボ群、イレッサ250mg群、500mg群に分けて集計した結果
図1
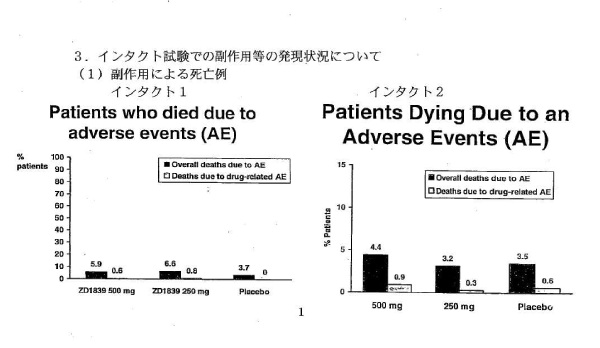
今回厚労省が示したINTACT-1およびINTACT-2の有害事象死亡率、副作用死亡率の結果を、上記図1に示す。左グラフは差がほとんどないようにみえ、右グラフの棒の方が大きいので、思わず右のグラフに目がいき、「差はないのか」と思ってしまいそうだ。
図2は、同じデータを同じスケールで現したものだ。
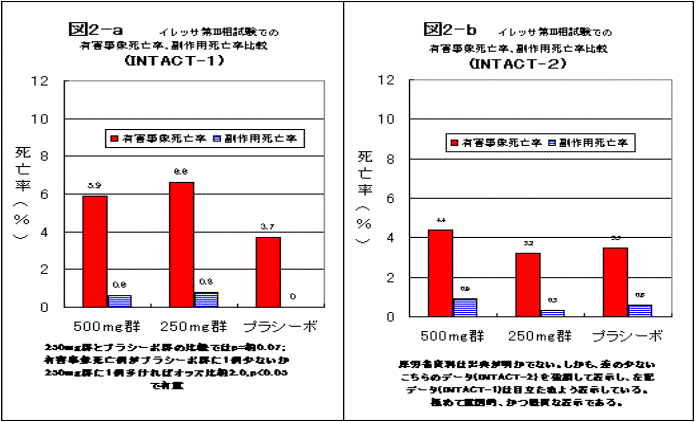
インタクト-1(左)は、プラシーボ群3.7%に対して、イレッサ500mg群では5.9%、250mg群では6.6%。イレッサ250mg群がプラシーボ群の2倍近い。左右のグラフを同じスケールで現した図2の方が真実を現しているし、「イレッサ250mg群の方が高い」との印象を受ける。
死亡人数が記載されていないので、実際に差が有意かどうか確実なところは不明だが、統計学的な検定を試みてみよう。
インタクト-1では、イレッサ群がそれぞれ365人ずつ、プラシーボ群は363人である。この数から、有害事象死亡者数はそれぞれ21人,24人,13人と推定できる。この数から、イレッサ250mg群とプラシーボ群有害事象死亡率を比較すると、カイ2乗値は3.38となり、p値は0.07程度である。イレッサ250mg群に1人でも死亡が多いか、プラシーボ群に1人でも死亡が少なければ、p<0.05で有意となる微妙な値である。
死亡率でこの程度の違いがあるので、死亡に至らないまでも重篤な有害事象も合わせて検討すれば、イレッサ群の方に重篤な有害事象が多くなることを容易に予想させる。生存期間の中央値は有意差なく、どちらかといえばイレッサ群の方が短かった。
このことも合わせて考えると、この有害事象死亡率を比較したデータは、イレッサが全体として、利益(生存期間延長)よりも危険(死亡を含め重篤な副作用が多く、生存期間を短縮する可能性)が大きいと判断すべき根拠となりそうな、極めて重要なデータである。
開示を要望した情報
「(1)期間別イレッサ使用実患者数(推定)、(2)期間別イレッサ販売数量(推定)」
今回の検討会で出された発売開始当初のイレッサ使用人数が大幅に訂正され、増加している(10月13日までで、7000人としていたのが、9月末で9600人、10月末で1万人が10月末で1.5万人と増加)。
その理由は明かでないが、厚労省がこの種のデータをきちんと把握していることは明かであろう。ところが、安全性を検討するために不可欠の「期間別、総使用錠数の推移」に関するデータは一切開示しようとしない。この点でも極めて秘密主義をますます強めていると言わざるを得ない。
イレッサの使用が安全と主張するなら、アストラゼネカ社も厚労省も、薬剤の市販後の安全評価に不可欠な上記情報を、積極的に開示し、その安全性を証明するべきである。それができないのは、販売数両の増加とともに、死亡も含めた重篤な副作用が減少していないことが明らかになるため、それを恐れて情報開示を拒否していると解釈せざるを得ない。
それは、厚労省の発表とは裏腹に、表1を見れば一目瞭然である。
- 前回(2月6日)公表時に、12月の対策後に副作用症例死亡率が「20%」に低下したから、対策の効果があったとしていたが、今回は34%と上昇している。
- 12月5日公表時、10月の緊急情報発出の効果の証拠としていた、「14.7%」の症例死亡率は今回、何と「42.9%」に上昇した。
- 今回、症例死亡率の減少では理由にならなくなった。
- そこで今回対策の効果として持ち出してきたのが、投与開始日である。これでみて、対策発出後の死亡数や死亡率が少ないという。
- しかし開始日は症状発現日よりも以前であるため、死亡に至るまでに、より長期間要するだけである。これで減少しても、予防対策や使用方法の違いで死亡率が減少したことを、全く意味しない。次項(9.使用開始日別でも死亡率は上昇している)のデータがよく物語っている。
表1
| A)2002.12.5 | B)2003.2.6 | C)2003.5.2 | 将来 | |||
|---|---|---|---|---|---|---|
| 厚労省説明 | 公表時説明 | 公表時データ | ||||
| (%) | (%) | (%) | ||||
| 情報発出前(10/15日まで) | 41.3 | → | 48.5 | → | 51.9 | ? |
| 情報発出後(10/16〜11/25(23)) | 14.7 | → | 35.7 | → | 42.9 | ? |
| 情報発出後(10/15頃〜12/25(23)) | 31 | → | 41.0 | ? | ||
| 12月末対策後(12/26〜3/2) | 20 | → | 34.3 | ? | ||
| 3/3以降 | 17.1 | ? |
註a:副作用例数に対する副作用死亡数の比率(%)
- いずれの時期の症例死亡率も、経過とともに、確実に上昇している
- 前回(2月)に、12月対策後「20%」で対策の効果としていたのが今回34%と上昇した。
- 12月5日に緊急情報発出の効果としていた、14.7%な何と42.9%と上昇した。
- 「症例死亡率の減少」が理由にならなくなったので、対策以降に使用開始した症例で死亡が少ないことを、対策の有効性証明のために持ち出してきた。
- 使用開始日は症状発現日より早いために、死亡に至るまでに、より長期間要する。予防対策や使用方法の違いで死亡率が減少したことを、全く意味しない。
表2
| 2002年 | 2003年 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 10/15 | 10/23 | 12/5 | 12/26 | 2/6 | 5/2 | 将来 | ||||||
| 10月緊急情報発出前 | 13 | → | 39 | → | 57 | → | 71 | → | 82 | → | 95 | ? |
| 発出後〜12/26※ | 14 | → | 31 | → | 62 | → | 107 | ? | ||||
| 12月対策発出後1カ月(〜1/31) | 2 | → | 12 | ? | ||||||||
| 2/3〜3/23(7W) | 15 | ? | ||||||||||
| 最近1カ月(3/24〜) | 2 | ? | ||||||||||
| 小計 | 13 | 39 | 71 | 102 | 146 | 231 | ? | |||||
| 発現日不明 | 10 | 12 | 27 | 15 | ? | |||||||
| 合計 | 13 | 39 | 81 | 114 | 173 | 246 | ? | |||||
| 副作用死亡率(%) | 0.19 | 0.39 | 0.48 | 0.60 | 0.74 | 0.87 | ? | |||||
厚労省のデータ(多くのマスメディア報道データは厚労省のデータそのまま報道)とは裏腹に、死亡数の増加は著しい。表2をみれば一目瞭然である。
同じ時期の副作用死亡数が、時間の経過とともに、極めて急速に増加していることがわかる。これは症状発現時期別の報告数であり、死亡例が、症状発現から数カ月を経過してもなお報告が増加していることを意味している。
今回、厚労省は、副作用症状の発現日ではなく、処方開始日で分類して、副作用死亡数が減少したという主張に変更した。
処方開始から、症状が始まるまでに早い場合は1週間であるが、1カ月以上、場合によっては2カ月以上かかる。そして、発病から死亡までにやはり1カ月以上経過する場合も少なくない。したがって、これだけでも、処方開始して2カ月未満の例は報告されることが少ないであろう。しかも、死亡後速やかに報告されることはほとんど望めない。上記のように、今でも昨年10月15日以前に発症した死亡例が報告され続けていることが、なによりもそのことを物語っている。
したがって、処方開始時期別に集計した今回の結果は、死亡数や死亡率をより少なく見せるための単なるトリックでしかない。前回の症状発現時期での分類がもはや理由にならなくなったための苦肉の策でしかない。
厚労省が5月2日公表したデータに基づいて、症状発現日で分類した副作用死亡患者数は、12月26日までで推定234人に達する。使用開始から症状発現までの期間の中間値は約2週間である。したがって、その2週間前(12月中頃)までの推定イレッサ使用患者数(19000人)に対する比率が最も適切であるのでこれを計算すると、1.23%であった。前回(2月6日)公表データでは、これは0.84%であったので、その増加ぶりの著しさがわかる。
しかも、当然のことながら、処方開始日別の集計でも、これがトリックであることは、すでに次のデータで証明されている。
朝日新聞は、5月2日16時のインタネット速報版で、以下のように報道した。「厚労省の指示で、ア社が緊急安全性情報を出したのは10月15日。この日を境に副作用報告が殺到した。「警告」を受けた医師が患者を精査したことで、副作用報告が相次いだようだ。だが緊急安全性情報後に服用を始めた患者の死亡例は、1月末現在で12人しかいない。」
5月3日の同新聞は、「緊急安全性情報を出した昨年10月15日以前に服用を始めた人は162人で、投与開始から原則4週間入院する措置を講じた昨年12月27日以降の死者は14人。同省は「措置の効果が出ている」としている。」と、厚労省の報告を無批判に報道している。
しかし、5月2日の厚労省の報告のデータを詳細にみると、緊急情報後1月末まで12人だった死亡者が、約50人に増加している。したがって、12月の対策後の死亡者数14人も今後時間の経過とともに増加することは確実といえる。
市販後の副作用死亡率は、3〜4%
すでにLancetで報告されたように、市販後にイレッサを使用して副作用死した患者の数は、臨床試験の副作用死亡率をはるかに上回っている。
(1)東北大学データ
まず、Lancetに掲載された東北大学のデータでは、2カ月間にイレッサが使用された18人中4人が重症の間質性肺炎になり、そのうち2人が間質性肺炎で死亡した。もう一人の死亡例も癌の進行は認められていないと本文には書かれているので、関連が否定できない。少なくともこの比率(2例として11,1%、3例なら16.7%)は、日本の臨床試験(I相とII相合計)における副作用死亡率(133人中0例、0%)と比較して、統計学的に有意の差がある(2例で、fisherの直接確率法は、2例の場合p=0.01、3例なら、p=0.001)。
第Ⅱ相までの臨床試験合計の副作用死亡率(0.3%=2/677)と比較すれば、p<0.001で有意である。少数とはいえ、統計学的には、意味のあるデータである。
臨床試験番号No11では有害事象死亡率13.0%(69例中有害事象死亡9例)が記録されている。丁度この有害事象死亡率に相当する副作用死亡率であり、決して偶然のものとは言えないであろう。東北大学の副作用死亡率が、それほど極端とは言えないゆえんである。
(2)国立ガンセンターと長崎原爆病院のデータ
5月2日の検討会で配布された資料の中には、副作用死亡率が計算できるデータの記載されている報告が2件あった。いずれも多数例の報告であると断られている。
このうち、国立がんセンター中央病院と、同東病院のデータである。中央病院は7月から12月まで、東病院は6月から3月4日までと時期が異なることが気になるが、中央病院は112人中4人死亡(3,6%)、東病院は149人中1人(0.7%)であった。合計261人中5人(2.0%)であった。
長崎原爆病院では、102人に使用し、副作用死亡が5人(死亡率4.9%)であった。
表3
| 調査方法 | 症例数 | 副作用死亡 | 全臨床試験(II相まで)に対する | 日本の臨床 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 数 | % | オッズ比 | 95%信頼区間 | p | 試験に対するp | ||||||
| 日本の臨床試験 | 133 | 0 | 0 | ||||||||
| 第Ⅱ相までの全臨床試験 | 677 | 2 | 0.3 | 1.0 | |||||||
| 市販後自発報告 | 19000 | 234 | 1.23 | 4.2 | 1.04 | 17.0 | <0.05 | ||||
| (12月26日まで) | |||||||||||
| 東北大 | 18 | 2 | 11.1 | 42.2 | 5.6 | 319 | <0.001 | <0.01 | |||
| (否定し得ない1例を追加) | 3 | 16.7 | 67.5 | 10.5 | 434 | <0.001 | <0.001 | ||||
| 長崎原爆病院 | 102 | 5 | 4.9 | 17.4 | 3.3 | 91 | <0.001 | <0.05 | |||
| 国立がんセンター中央病院 | 112 | 4 | 3.6 | 12.5 | 2.3 | 69 | <0.01 | ||||
| 国立がんセンター東病院 | 149 | 1 | 0.7 | 2.3 | 0.2 | 25 | 差ナシ | ||||
| 市販後調査総計 | 381 | 12 | 3.2 | 11.0 | 2.4 | 49 | <0.001 | ||||
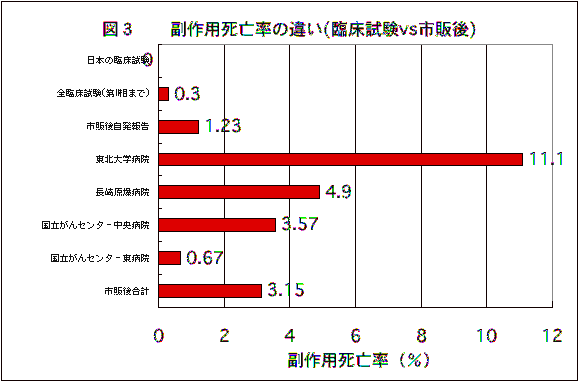
図3にこの表のデータを示した。

(3)市販後使用調査の合計
これら市販後の詳細な調査を合計すると、381人中12人(3.2%)もしくは、381人中13人(3.4%)(東北大の例を3例とすると)となる。
これは第Ⅱ相までの全臨床試験データ(677人中2人)に比較して、有意であった(p<0.001)。
このように、臨床試験のデータがいかにずさんであったか。一目瞭然である。
不完全なデータではあるが、イレッサによる副作用死亡率が少なくとも、3%以上であることは、集中的な調査がおこなわれた、これら多数を扱う病院でのデータが物語っている。
3%の死亡率とすれば、28300人が使用すれば、850人、4%なら、1100人を超えることになる。寿命は延長せず、死亡率はイレッサを使用した方が高い、つまり、害の方が利益よりも大きい可能性があるのであるから、これはもはや、くすりとしては扱えない。
これだけ求めてもデータを出そうとしない厚労省の対応には、今後改善する余地がないものと結論づけざるを得ないようである。
これまでには、数件の臨床試験が実施されていたが、すべて試験は中止となっている。プラシーボ群との試験では、イレッサ群の一人が死亡した。
これまでの検討で、いくつか危険因子が判明したので、8月から臨床試験を再開することが、示されたが、これまでの再三請求してきた、承認審査資料の全面開示がなされないまま、臨床試験を再開しても、これまでの轍を繰り返すだけであろう。
NPOJIPが要請してきた、情報公開を求める。