プロトピック軟膏の最大の問題点「発がん性」について一般市民やマスメディア、さらには医療従事者から、何がどのように問題なのかが分かりにくいとの指摘をよく聞く。また、発がん性に関する情報を患者に提供することが承認の条件とされているにもかかわらず、藤沢薬品やその宣伝パンフレット、宣伝講演会等に登場する医学研究者(例えば竹原和彦金沢大医学部皮膚科教授など)の文書や発言には、発がん性無視ともとれる表現が横行している。さらには、当医薬ビジランスセンターの科学的根拠に基づいた問題点の指摘に対して、「意図的に混同させる部分が多く」「意図的に患者様の不安を煽るものであり」「信用に足りうるものではなく」「要望が誤解に基づくもの」で「プロトピック軟膏バッシングがなされている」と発言している。
プロトピック軟膏の「発がん性」問題のポイントを今一度整理し、強大な資金力を背景に製薬企業と研究者・行政が進めている情報非公開・科学論争回避をどう打開したらよいかを考えたい。
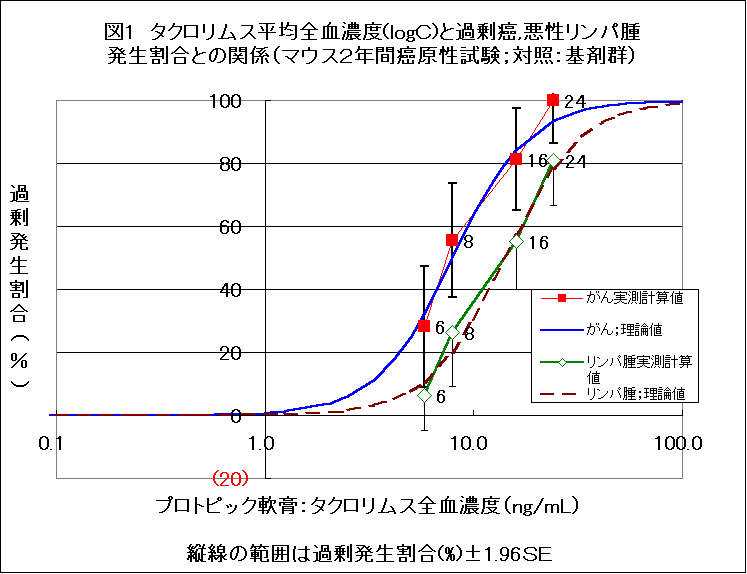
マウスを用いた塗布発がん実験において、0.03%群はがん全体でも悪性リンパ腫に限っても、有意にがんが増加し、新たながんの発生割合(注1 )は、プロトピック軟膏の成分タクロリムスの血中濃度の増加に応じて増加し、理論曲線(注2 )によく一致する濃厚な濃度−反応関係が見られている。
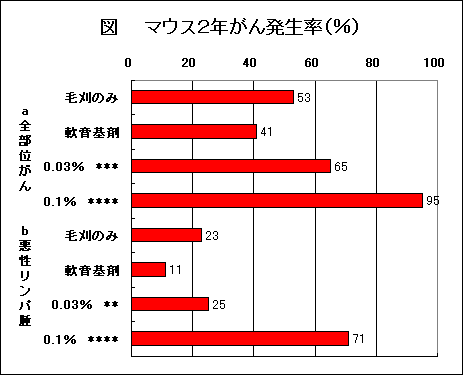
では、藤沢薬品がなぜ「発がんなし」としているのか? 理由は簡単である。図のように動物実験は4つの群で行っているが、藤沢薬品は「軟膏基剤」群を無視して、本来対照群とはならない「毛刈のみ」を対照群として採用しているからである。
そこで、今一度、日欧米の製薬業界と政府による医薬品評価の取り決め「ICH のガイドライン」(注3 )の記載がどうなっているかをみておこう。
がん原性試験に関するICH のガイドラインにおいて、対照群は、
と規定されている。
内服剤、注射剤、外用剤に限らず多くの被験物質には、主成分を溶かし込んでおくために「溶媒、乳化剤等」が含まれる。プロトピック軟膏の場合は主成分以外にワセリンが「軟膏基剤」として含まれており、これが「溶媒、乳化剤等」に相当する。したがって、「軟膏基剤」群がICH が定める正規の対照群である。なお、ICH のガイドラインでは上記に続けて、「また、その他に無処置対照群を置くことが望ましい。」と記載されている。その理由は、基剤(や毛刈という処置)の毒性を知るためである。藤沢薬品が設定した「毛刈り」群はICH のガイドラインで規定している「無処置」対照群に当てはまらない。
厚生省薬務局(現厚労省医薬品食品局)審査管理課の編集による「医薬品毒性試験法ガイドライン解説1990」によれば、がん原性の有無の判定は通常、生存率に差がなければフィッシャー法(注4 )で発がんの割合の差を検定し、生存率に差があればピトー法(注5 )という方法で解析することとされている。
プロトピック軟膏0.03%群は生存率に差なく、0.1 %群は生存率に差があったので、0.03%群はフィッシャー法を用い、0.1 %群のみピトー法を用いて解析をすればよい。
これらのガイドラインどおりに「軟膏基剤群」を対照とし、生存率に差がないためがん発生割合をフィッシャー法で検定すると0.03%群の軟膏基剤対照群に比較してp 値は0.00053 であった。毛刈のみの群を対照としてもp 値は0.057 であった(通常p 値が0.05未満であれば有意と考える)。
したがって、軟膏基剤群を対照とし、適切な解析方法を用いれば0.03%群は意味のある発がん濃度であることが分かる。
藤沢薬品は、「プロトピック軟膏の使用量の上限1 日10g の使用をずっと続けても、 血中への移行は徴量で心配ない」との立場をとっている。これは明らかに承認条件の逸脱である。
われわれの分析では、1 日10g 塗布時の平均血中濃度は2 〜3ng/mLと推定された。この濃度はマウス塗布がん原性0.03%群の血中濃度2 〜4 分の1 、藤沢薬品でも確実な発がん濃度とした0.1 %群を規準としてもわずか5 〜12分の1である(藤沢薬品は5 〜10分の1 としている)。また、臓器移植後に内服したヒトの平均血中濃度(14ng/ml)の5〜7分の1である(注6)。
比較したのは平均血中濃度である。個体差と多数への使用を考慮すれば、さらに血中濃度が高くなる人がいるはずである。免疫系細胞への影響は0.1ng/mLでも生じ、2 〜3ng/mLという濃度は、決して徴量でない。多数に長期間使用されると、がん原性は無視し得ない濃度となる。
しかも藤沢薬品は、血中濃度「0.5ng/mL未満」は「ゼロ」として平均血中濃度を計算するなどして、平均血中濃度を低く見せようとする操作も行っている。
すでに海外では臨床試験でも市販後も、悪性リンパ腫が報告され、日本でも悪性リンパ腫が最近報告された(速報No33、No34参照)。これらの事実は重く受け止めなければならない。
NPO法人医薬ビジランスセンターは、医薬品・治療研究会とともに、種々の薬剤の有効性、安全性に関して科学的根拠に基づく検討を加え、情報を発信している。
今回のプロトピック軟膏に関しても十分に検討したうえで、「プロトピック軟膏は危険」との結論に達した。そのうえで、問題点を薬事・食品衛生審議会、薬事分科会各委員に直接送付し、一定の影響力を与えることはできたようである。しかし、藤沢薬品が全国的に配付しているパンフレット類の誤りに対しては、いかなる手段があるだろうか。そのパンフレットの著者竹原教授に対して、科学的誤りを指摘し節度ある科学的根拠に基づく発言を求めたところ、「個人の表現の自由」という、理由にならない理由を挙げて、科学的問題指摘に対する回答は拒否された(注7)。
科学的根拠に基づき問題提起された有効性、安全性にかかわる重要事項は、本来、国の承認に際して、問題提起する側が参加する場において検討されるべきものである。市販後においても国の意志決定過程において、問題提起した側が参加した上で、冷静な科学的議論がなされなければならない。
しかし、現在、情報開示は後退し、そうした冷静な科学的議論が可能な場は、ごくまれな機会を除いて皆無に等しい。
薬害の被害者や市民、マスメディア、医療従事者、それに医薬の安全やリスク管理に関心のある法律家には、問題薬剤に関して、科学的議論の場の設定の必要性を認識され、それを実現するべく、世論の形成に努力されることを期待する。
タクロリムスの従来の適応で内服したヒトの平均血中濃度(14ng/mL)は、外用剤として用いたプロトピック軟膏のマウス塗布がん原性試験(0.03と0.1 %群濃度の中間)とほぼ同レベルであった。
臓器移植でタクロリムスを使用した場合、小児では約5年の追跡で、10%前後から最大20%のリンパ腫発生が報告されており、多くは10%を超え、他のがんも含めるとその2.5 〜3 倍の割合でがんが発生する。同効剤のシクロスポリンでは成人でも10年を超えると15%にリンパ腫の発生が報告されている。これらを考慮すると、ヒトでも長期に追跡すれば、発がんは数10%におよぶ可能性があり、血中濃度が同レベルのマウス実験の超過がん発生割合に近い割合となり得る。
血中濃度が同等ならヒトでもマウスでも同程度に発がんすると考えられるのである。
プロトピック軟膏の最大の問題点は発がん性である1-3)。患者だけでなく、一般市民、マスメディア、さらには医療従事者のなかにも、その問題点がわかりにくいとの指摘をよく聞く。また、患者への発がん性に関する情報提供の条件がつけられているにもかかわらず、藤沢薬品やその宣伝パンフレット等に登場する医学研究者の文書には、発がん性無視ともとれる表現が横行している4,5)。そこで、最新の分析結果も交えながら、なぜ発がん性が問題になりうるのか、ポイントを解説したい。
動物実験(マウス)では、超過がん発生割合(excess cancer risk:新たながんの発生割合:註a)はプロトピック軟膏の成分タクロリムスの血中濃度の増加に応じて増加し、理論曲線によく一致する関連がある2)。悪性リンパ腫についても、同様に理論曲線に合致していた(図1)。対照群として軟膏基剤群を用いた方が、毛刈のみ群を用いた場合よりもよい一致を示した。
註a:「超過がん発生割合」は、タクロリムスの曝露を受けていなければ本来がんが発生しなかったマウスの何%に新たに「がん」が発生したか、その割合をみたもの。超過悪性リンパ腫発生割合も同様である。
藤沢薬品は、マウス塗布がん原性試験の検討に、「対照群(第1群)は、毛刈のみとした。」と記載している6,7)。また、藤沢薬品やそのパンフレットに登場する研究者は「一般に毛を刈っただけの無処置群を対照とするのが常識だ.」として0.03%群では「発がんは有意でない」としている8)。
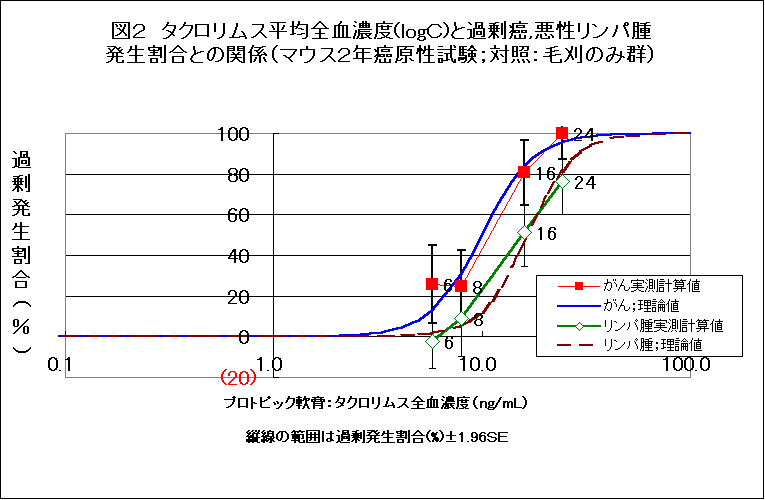
しかしながら、毛刈のみのマウスと比較してタクロリムスの濃度と超過がん発生割合との関係をみると(図2)、全がん、悪性リンパ腫とも、理論曲線からかなりずれる。とくに、0.03%群の悪性リンパ腫で、そのズレが著しい。軟膏基剤を対照とした場合のよい一致と比較して、その違いは印象的である。
ただし、0.03群の全部位のがんの発生割合は、毛刈のみ群との間で比較しても、p=0.057であり、一般的有意水準であるp=0.05に近い。
そこで、今一度、ICHのガイドライン9)の記載がどうなっているかをみておこう. ICHのガイドラインでは、
(1) 対照群
と記載されている。
プロトピック軟膏の基剤は必須成分であるから、マウス塗布がん原性試験では「溶媒、乳化剤等を必要とする場合」に相当する。したがって、「軟膏基剤」塗布群が正規の対照群である。「その他に無処置対照群を置くことが望ましい」とされているのは基剤や溶媒、乳化剤(あるいいはこの場合、毛刈という処置)が、単独でも強い毒性を示す可能性を除外するために対照として必要なものである。
軟膏基剤の毒性の可能性を除外するためには、毛刈のみの群を対照群としておくことは、必要であろう。しかし、毛刈のみの群が必要である理由は、軟膏基剤そのものの毒性を検討するためである。タクロリムス(プロトピック軟膏の成分)の発がん性を検討するための対照ではない。しかもこの実験では対照群である毛刈のみの群の方が悪性リンパ腫の発生が多いという現象が起きた。これは毛刈のみでも、悪影響が現れうる可能性をうかがわせる。
したがって、毛刈のみの影響を検討するため、毛刈もしない、全くの「無処置」群も対照群として観察すべきであった。したがって、マウス塗布がん原性でタクロリムスの影響を検討するために、
である。
メーカーの資料10)では、0.1%の雌雄で、悪性腫瘍数およびリンパ腫がPeto mortality prevalence 解析の結果、統計学的にも有意の増加、別のメーカー資料7) では0.1%の雌雄でリンパ腫の有意な増加、また別の資料6) では0.1%の雄のみでリンパ腫の有意な増加を認められたとしている。このように、0.1%群の悪性腫瘍の発生についてのデータに記載が一定しない。その理由は不明であるが、いずれにしても、0.03%群では雌雄いずれも、悪性腫瘍数およびリンパ腫の増加はなかったとされている6,7,10)。
がん原性の有無の判定のための統計学的処理は通常、生存率に差がなければFisherの直接確率法、生存率に差があればPeto mortality prevalence 解析11,12)が行われる12-14)。
プロトピック軟膏では0.1%群は生存率に差があり、0.03%群は生存率に差はなかった10)。したがって、0.1%群はPeto mortality prevalence 解析をし、0.03%群はFisherの直接確率法を用いて検定すればよい。その結果を表に示した。
0.03%群では全部位がんが、毛刈のみの群を対照としてもp=0.057であった。
| タクロリムス | 対照 | 生存率 | 望ましい | がん発生割合(%) | オッズ | オッズ比 | Fisher法 | 有意 | |
|---|---|---|---|---|---|---|---|---|---|
| 濃度(%) | 有意差 | 検定法 | プロトピック | 対照 | 比 | 95%CI | p値 | 差 | |
| 全部位がん(雄雌合計) | |||||||||
| 0.03 | 毛刈のみ | なし | Fisher | 65 | 53 | 1.6 | 0.93, 2.9 | 0.057 | |
| 0.1 | 毛刈のみ | あり | Peto | 95 | 53 | 16.8 | 6.3, 45.0 | 1.8X10-12 | あり |
| 0.03 | 軟膏基剤 | なし | Fisher | 65 | 41 | 2.7 | 1.5, 4.7 | 0.00053 | あり |
| 0.1 | 軟膏基剤 | あり | Peto | 95 | 41 | 27.3 | 10.2, 73.1 | 9.28X10-18 | あり |
| 悪性リンパ腫(雄雌合計) | |||||||||
| 0.03 | 毛刈のみ | なし | Fisher | 25 | 23 | 1.1 | 0.6, 2.1 | 0.434 | なし |
| 0.1 | 毛刈のみ | あり | Peto | 71 | 23 | 8.2 | 4.3, 15.5 | 5.5X10-12 | あり |
| 0.03 | 軟膏基剤 | なし | Fisher | 25 | 11 | 2.7 | 1.2, 5.8 | 0.008 | あり |
| 0.1 | 軟膏基剤 | あり | Peto | 71 | 11 | 19.8 | 9.3, 42.4 | 5.2X10-19 | あり |
Fisher:Fisherの直接確率法
Peto:Peto mortality prevalence test
95%CI:95%信頼区間
* Peto mortality prevalence 解析をするために必要なデータは示されていないので、参考のため、
0.1%群についてもFisherの直接確率法によるp値を示した。
臓器移植の拒絶反応予防に維持量を内服した場合の平均血中濃度は、10〜20ng/mL(平均約14ng/mL)である。この濃度は、マウス塗布がん原性試験0.03と0.1%群の濃度をほぼ同等であり、平均値(14ng/mL)は、メスの0.03%群とメス0.1%群の平均血中濃度のちょうど中間的濃度である1,2)。
藤沢薬品やその宣伝パンフレット等に登場する医学研究者は、「12歳未満8.5%、12歳以上O.8%」「小児腎移植患者ではタクロリムを使用しない場合(1.1%)と使用した場合(O,9%)とほぼ差がないというデータもでている」などとしている4,5)が、医薬ビジランスセンターの調べでは、小児では約5年の追跡で、10%前後から最大20%の悪性リンパ腫等の発生が報告されており、その多くは10%を超えていた2)。この他、がん全体としては、2.5〜3倍の悪性腫瘍(がん)が発生する2)。
同効のシクロスポリンを移植後10年以上使用した場合の成人の悪性リンパ腫発生率は15%であった。これらを考慮すると、人での超過がん発生割合は、長期に追跡すれば、数10%に及ぶ可能性は大きく、血中濃度が同レベルのマウス実験の超過がん発生割合に近い割合となり得る。
つまり、血中濃度が同等であれば、ヒトでもマウスでも同程度に発がんする(本来はがんが発生しないヒトや動物に余分にがんが発生する)と考えられる。
藤沢薬品やその宣伝パンフレット等に登場する医学研究者は、「プロトピック軟膏の使用量の上限は1日10gですが、この量の使用をずっと続けていたとしても、血中への移行は徴量で内服薬のような心配はありません。」としている4,5)。これだけでも、承認条件の逸脱であろう。
医薬ビジランスセンターの精査では、1日10g塗布による平均血中濃度は2ng/mLと推定された(0.5ng/mL未満を0としなければ更に高くなろう)。この濃度はマウス塗布がん原性0.03%群の血中濃度3〜4分の1、藤沢薬品でも確実な発がんとした0.1%群血中濃度のわずか8〜12分の1である(藤沢薬品は5〜10分の1としており、このことを認めている)。
しかもこれは平均血中濃度である。個体差と多数への使用を考慮すれば、さらに血中濃度が高くなる人がいるはずである。
免疫系細胞への影響は0.1ng/mLでも生じ、2ng/mLという濃度は、決して徴量でない。多数に長期間使用されると、がん原性は無視し得ない濃度となる。平均0.5ng/mL以上の濃度を持続する例は少なくない。
血中濃度は0.025ng/mLまで測定可能であるのに、0.5ng/mLが測定限界の方法で測定し、0.5ng/mL未満は血中濃度0ng/mLとして平均血中濃度を計算し、平均血中濃度を低く見せている。
アメリカの臨床試験でも市販後にも悪性リンパ腫が報告されている.また、プロトピック軟膏を3年間使用中であった16歳の少女に悪性リンパ腫(おそらく皮膚が原発で全身播種型)が日本でも発見され3)、すでに厚生労働省に報告されている。
医療現場において発がんし得ることを念頭におき、注意深い観察が求められよう。